Sản phẩm phụ của phản ứng bao gồm: nguyên liệu curcumin, hợp chất mono- O-(2-hydroxyethyl)curcumin (PH6) và có thể là các tri-(2-hydroxyethyl)curcumin (PH6c, PH6d) (Hình 4.3). Để thu được hiệu suất cao sản phẩm PH7, cần chú ý kiểm soát tốt tỷ lệ mol của curcumin : 2-bromoethanol cho phản ứng này. Ngoài ra, cǜng như phản ứng tạo dẫn chất monohydroxyethyl, điều kiện tiến hành phản ứng tạo PH7 phải đảm bảo khan để tránh làm hỏng tác nhân bromethanol và phát sinh một số tạp oxy hóa khác.
4.1.4. Bàn luận về phản ứng tạo các dẫn chất monoester glutarat (PH8) và succinat (PH9 và PH10)
4.1.4.1. Về tổng hợp dẫn chất mono-O-(2-(succinyloxy)ethyl)curcumin (PH9)
![]()
![]()
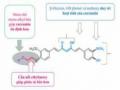
Phản ứng acyl hóa PH6 sử dụng tác nhân anhydrid succinic với chất xúc tiến pyridin có thể xảy ra theo hai cơ chế (a) và (b) được thể hiện qua sơ đồ sau (Hình 4.5) [12], [66]:
![]()
![]()
Có thể bạn quan tâm!
-
 Kết Quả Khảo Sát Ảnh Hưởng Của Nồng Độ Tác Nhân Tới Hiệu Suất Phản Ứng Ở Quy Mô 5 G/ Mẻ
Kết Quả Khảo Sát Ảnh Hưởng Của Nồng Độ Tác Nhân Tới Hiệu Suất Phản Ứng Ở Quy Mô 5 G/ Mẻ -
 Kết Quả Khảo Sát Độ Lặp Lại Của Quy Trình Tổng Hợp Ph9 Ở Quy Mô 2 G/mẻ
Kết Quả Khảo Sát Độ Lặp Lại Của Quy Trình Tổng Hợp Ph9 Ở Quy Mô 2 G/mẻ -
 Đánh Giá Độc Tính Cấp Trên Chuột Thử Nghiệm Sơ Bộ:
Đánh Giá Độc Tính Cấp Trên Chuột Thử Nghiệm Sơ Bộ: -
 Cấu Trúc Ph3 Và Các Giá Trị Tín Hiệu Proton, Carbon Trong Phân Tử Trên Phổ Nmr
Cấu Trúc Ph3 Và Các Giá Trị Tín Hiệu Proton, Carbon Trong Phân Tử Trên Phổ Nmr -
 Bảng Kết Quả Phân Tích Phổ 1H-Nmr, 13C-Nmr Và Dept Của Ph9
Bảng Kết Quả Phân Tích Phổ 1H-Nmr, 13C-Nmr Và Dept Của Ph9 -
 Cấu Trúc Ph12 Và Các Giá Trị Tín Hiệu Proton, Carbon Trong Phân Tử Trên Phổ Nmr
Cấu Trúc Ph12 Và Các Giá Trị Tín Hiệu Proton, Carbon Trong Phân Tử Trên Phổ Nmr
Xem toàn bộ 442 trang tài liệu này.
Hình 4.5. Sơ đồ cơ chế phản ứng acyl hóa tạo PH9
Trong cấu trúc phân tử PH9 còn 1 nhóm –COOH tự do và 1 nhóm ester có khả năng bị thủy phân, nên phản ứng cần tiến hành ở nhiệt độ lạnh 5–10 °C và cần xử lí nhanh để tránh thủy phân liên kết ester. Để hạn chế sản phẩm sang pha nước và loại các tạp ion, chúng tôi sử dụng rửa với dung dịch NaCl bão hòa, sau đó rửa lại với nước.

4.1.4.2. Về tổng hợp muối natri của mono-O-(2-(succinyloxy)ethyl)curcumin (PH10)
NaHCO3 được sử dụng để tạo chọn lọc PH10 do NaHCO3 không tạo ra sản phẩm phụ là muối phenolat đồng thời NaHCO3 là kiềm yếu (pH dung dịch bão hòa bằng 8,4) nên hạn chế được thủy phân liên kết ester so với kiềm mạnh hơn như NaOH và Na2CO3.
Để lựa chọn dung môi phản ứng, chúng tôi đã căn cứ vào độ tan của NaHCO3 (ở 22 °C): rất tan trong nước, không tan trong ethanol, ít tan trong aceton (0,02 %), tan trong methanol (2,13 %) và của PH9 (hơi tan trong methanol và aceton). Theo đó, aceton có ưu điểm hơn methanol: aceton hòa tan NaHCO3 ít hơn so với methanol, hạn chế được lượng hydrocarbonat dư trong dịch sau lọc, bên cạnh đó aceton cǜng giúp sản phẩm thu được ổn định hơn, trong khi methanol có hydro linh động có thể thủy phân/alcol phân liên kết ester ở môi trường kiềm.
Dư lượng kiềm ảnh hưởng đến độ ổn định của sản phẩm trong quá trình bảo quản nên lượng NaHCO3 sử dụng trong phản ứng phải đủ để dạng acid PH9 chuyển hoàn toàn thành dạng muối PH10 và hạn chế tối đa lượng NaHCO3 dư, do đó cần kiểm soát chặt chẽ tỷ lệ mol của NaHCO3 khi thực hiện phản ứng.
Trong quá trình thực nghiệm, PH10 được nghiên cứu tổng hợp thông qua hai phương án: tạo PH10 qua giai đoạn tách riêng PH9 (phương án A) và tạo muối PH10 từ PH6 không qua giai đoạn tách PH9 (phương án B). Kết quả cho thấy, phương án B dễ thực hiện, tiết kiệm thời gian hơn, hiệu suất quá trình cao hơn (67,38 % so với 52,48 %) so với phương án A do PH9 bị mất một phần trong quá trình rửa tủa với methanol. Vì vậy, phương án B là một hướng được lựa chọn để tổng hợp one-pot cho muối natri mono-O-(2-(succinyloxy)ethyl)curcumin (PH10).
4.1.4.3. Về tổng hợp dẫn chất mono-O-(2-(glutaryloxy)ethyl)curcumin (PH8)
Phản ứng tổng hợp PH8 là phản ứng acyl hóa PH6 sử dụng tác nhân anhydrid glutaric với xúc tác pyridin, xảy ra tương tự như tổng hợp PH9 về cơ chế, điều kiện phản ứng và các khả năng sản phẩm phụ. Tuy nhiên, do anhydrid glutaric là tác nhân acyl hóa yếu hơn so với anhydrid succinic, nên quy trình sử dụng tỷ lệ mol anhydrid nhiều hơn và thời gian phản ứng dài hơn so với tổng hợp PH9. Thực nghiệm cǜng chỉ ra, sử dụng phương pháp chiết (HCl lạnh và CuSO4 bão hòa) làm phân hủy đáng kể sản phẩm và hầu như không thu được PH8 như mong đợi. Chính vì vậy, chúng tôi đã sử dụng phương pháp sắc ký cột để tinh chế.
4.1.5. Bàn luận về phản ứng tạo các dẫn chất diester glutarat (PH14) và succinat (PH15)
4.1.5.1. Về tổng hợp di-O-(2-(glutaryloxy)ethyl)curcumin (PH14)
Năm 2018, Muangnoi và các cộng sự đã thực hiện phản ứng acyl hóa trực tiếp curcumin bằng anhydrid glutaric nhằm tạo ra dẫn chất curcumin tan [113]. Các tác giả đã sử dụng dung môi là dicloromethan, xúc là triethylamin, ở nhiệt độ 40 °C
(hồi lưu) trong thời gian 2 giờ cho sản phẩm diacyl hóa đạt hiệu suất 85%. Tuy nhiên, khi chúng tôi sử dụng điều kiện này để glutaryl hóa curcumin và PH7, thì hầu như phản ứng xảy ra kém và không tinh chế được sản phẩm, đặc biệt là với curcumin. Chính vì vậy, chúng tôi đã thay dicloromethan bằng dung môi cloroform nhằm nâng cao nhiệt độ (hồi lưu) và rút ngắn thời gian phản ứng và chỉ thực hiện với nguyên liệu PH7 để tạo PH14. Trong đó, cloroform cần được tinh chế ngay trước khi thực hiện acyl hóa để có hiệu quả tốt.
4.1.5.2. Về tổng hợp di-O-(2-(succinyloxy)ethyl)curcumin (PH15)
Phản ứng acyl hóa PH7 tạo PH15 sử dụng tác nhân anhydrid succinic với xúc tác triethylamin xảy ra theo cơ chế tương tự như phản ứng tạo PH9 (Hình 4.5) và được thực hiện theo phương pháp của tác giả Muangnoi và các cộng sự (2018) [113], tương tự như với quy trình tổng hợp PH14. So với tổng hợp PH14 (anhydrid glutaric), phản ứng tổng hợp PH15 sử dụng tác nhân acyl hóa mạnh hơn, lượng tác nhân sử dụng ít hơn và thời gian phản ứng rút ngắn hơn.
Sắc ký lớp mỏng cho thấy, phản ứng không tạo ra duy nhất một sản phẩm, mà xuất hiện một vết chính và một số vết phụ. Các vết phụ này được dự đoán là nguyên liệu PH7, tạp mono ester PH15a và tạp tri ester PH15b (Hình 4.6). Khi xử lý phản ứng, chúng tôi đã tìm được dung môi là isopropanol để loại đi các tạp này.
Hình 4.6. Các khả năng tạo tạp của phản ứng tổng hợp PH15
Trong quá trình ester hóa, cần kiểm soát nồng độ tác nhân anhydrid. Nồng độ loãng (lượng dung môi > 30 mL) dẫn đến thời gian phản ứng kéo dài, trong khi không làm tăng hiệu suất phản ứng. Nồng độ tác nhân đặc (lượng dung môi < 10
mL) làm tăng khả năng tạo tạp chất PH15b. Chúng tôi đã lựa chọn lượng dung môi hợp lý là 20 mL. Cần chú ý là, PH15 có các các liên kết ester và COOH nội phân tử, nên cần xử lý khối phản ứng ở điều kiện lạnh. Giai đoạn cất quay loại dung môi cần cất ở nhiệt độ thấp (30–35 °C) tránh thủy phân liên kết ester.
4.1.6. Bàn luận về phản ứng tạo các dẫn chất phosphat PH11 và PH12
4.1.6.1. Về phản ứng tổng hợp 2-(curcumin-O-yl)ethyl dihydrophosphat (PH11)
Phản ứng phosphat hóa tạo PH11 có thể được thực hiện nhờ một số phương pháp như: Sử dụng tác nhân acid phosphoric hoặc sử dụng tác nhân phosphoryl clorid. Thực nghiệm chỉ ra, sử dụng tác nhân acid phosphoric cho hiệu suất thấp (12,71%). Chúng tôi thử nghiệm tác nhân phosphoryl clorid theo phương pháp của
![]()
![]()
T. Sowa [162] thu được kết quả tốt hơn (67,74%). Tác nhân phosphoryl clorid kết hợp pyridin và nước có một số ưu điểm như: chọn lọc vào alcol bậc 1, hiệu suất tương đối cao, phù hợp với điều kiện phòng thí nghiệm nên đã được lựa chọn trong phản ứng này. Cơ chế của phản ứng có thể xảy ra như ở hình sau [162]:
![]()
![]()
![]()
![]()
Hình 4.7. Cơ chế phản ứng phosphoryl hóa bằng tác nhân POCl3 [162]
Phối hợp phosphoryl clorid với pyridin và nước ở tỷ lệ mol 2 : 2 : 1 tạo thành chất trung gian tetracloropyrophosphat (P2O3Cl4) là tác nhân phosphat hóa chọn lọc (chỉ tạo monophosphat trên OH alcol bậc 1 của PH11, không ảnh hưởng đến OH phenol và enol của khung cấu trúc curcumin).
Các khảo sát chỉ ra, tỷ lệ mol tối ưu POCl3 : PH6 = 15 : 1, khác với tài liệu đã tham khảo (tỷ lệ mol POCl3 : PH6 = 5 : 1). Các thông số còn lại tương tự như tài liệu tham khảo: nhiệt độ 0–2 °C, dung môi acetonitril, thời gian phản ứng 4 giờ. Nhiệt độ lạnh giúp hạn chế quá trình thủy phân POCl3 và P2O3Cl4 thành H3PO4. Lượng nước đưa vào khối phản ứng cǜng cần được kiểm soát ở tỷ lệ như sau: POCl3
: nước : pyridin =2: 1: 2.
Khi xử lý phản ứng, tạp nguyên liệu PH6 dư được loại đi nhờ rửa với diethyl ether; còn các tạp tan trong nước (muối pyridin hydroclorid, phosphat vô cơ) cǜng được loại đi khi chiết sản phẩm với ethyl acetat. Thực nghiệm chỉ ra, sản phẩm thô acid PH11 kém ổn định, dễ bị thủy phân thành PH6 do có nhóm ester và acid nội phân tử. Việc điều chỉnh pH về 1-2 có vai trò trung hòa acid phosphoric tự do (sinh ra khi xử lý phản ứng), từ đó hạn chế được sự thủy phân sản phẩm PH11 ở các thao tác tiếp theo.
4.1.6.2. Về phản ứng tạo muối dinatri 2-(curcumin-O-yl)ethyl phosphat (PH12)
Phản ứng tạo PH12 là phản ứng tạo muối acid hydrophosphat và kiềm carbonat cho hiệu suất khá tốt (95,47 %). Khi xử lý dịch phản ứng (pH 9) bằng ether, hầu như không quan sát thấy vết của nguyên liệu PH11 trong dịch chiết lần 2 và 3. Thực nghiệm chỉ ra, PH12 hầu như không tan trong ether.
4.1.7. Bàn luận về phản ứng tạo dẫn chất sulfat PH13
![]()
![]()
![]()
Phản ứng được thực hiện dựa theo phương pháp của tác giả Mumma (1966) [115]: tổng hợp sulfat ester qua trung gian DCC bằng cách gắn nhóm sulfat qua cầu oxyethyl của dẫn chất trung gian PH7 để tạo ra PH13. Cơ chế phản ứng sulfat hóa trung gian PH7 được giải thích trong tài liệu [18] thể hiện qua hình 4.8 dưới đây. Liên kết S-O của acid sulfuric được hoạt hóa nhờ DCC thông qua trung gian A, sau đó phản ứng với nhóm OH trong phân tử PH7 tạo thành sản phẩm ester hóa.
![]()
![]()
Hình 4.8. Cơ chế phản ứng sulfat hóa PH7 qua trung gian DCC [18]
Thứ tự thêm vào của các chất phản ứng là yếu tố quan trọng dẫn đến sự hình thành của sản phẩm sulfat. Phản ứng được chúng tôi thực hiện theo trình tự: (1) DCC, (2) nucleophil (alcol PH7), (3) H2SO4. Nếu phản ứng được thực hiện theo thứ tự: (1) H2SO4, (2) nucleophil , (3) DCC, thì nucleophil sẽ bị phân hủy trước khi DCC được thêm vào. Ngoài ra, nếu trình tự phản ứng: (1) DCC, (2) H2SO4, (3)
nucleophil , thì sản phẩm sulfat cǜng không được tạo thành do DCC và H2SO4 phản ứng trực tiếp với nhau trong dung môi DMF tạo thành dicyclohexylure [68]. DCC dễ hút ẩm và gây dị ứng mạnh khi tiếp xúc với da, vì vậy khi thực hiện phản ứng cần thao tác nhanh và cẩn thận. Phản ứng cần được duy trì ở nhiệt độ thấp trong suốt tiến trình để tránh sulfat hóa DMF và tránh tạo ra các sản phẩm phụ khác [115]. Ngoài ra, PH7 có 2 nhóm OH alcol, nên có thể tạo sản phẩm sulfat hóa không chọn lọc trên 1 hoặc cả 2 nhóm này (Hình 4.9). Chúng tôi đã lựa chọn tỉ lệ mol các chất tham gia phản ứng (nuleophin : DCC : H2SO4 = 1 : 5 : 1) và nồng độ loãng để kiểm soát, ưu tiên tạo sản phẩm monosulfat hóa.
Hình 4.9. Các sản phẩm có thể có ở phản ứng tổng hợp PH13
Trong quy trình xử lý, pha nước được rửa với dicloromethan và ethyl acetat để loại hầu hết DMF cǜng như tạp nguyên liệu. Tạp DCU kết tủa trong methanol và được lọc loại đi. Sản phẩm phụ disulfat khó tan trong isopropanol, nên chúng tôi đã sử dụng isopropanol để tinh chế.
4.1.8. Bàn luận về phản ứng tạo liên hợp PH16
Về phản ứng tổng hợp N-Boc-valin:
Lai hóa curcumin và acid amin được một số tác giả nghiên cứu nhằm cải thiện độ tan, trong đó có thể sử dụng cầu nối ester trực tiếp với OH phenol của khung curcumin. Nhóm amin (-NH2) tạo thành có khả năng tạo muối ở pH acid, qua đó cải thiện được độ tan của dẫn chất [128]. Để tổng được PH16 từ dẫn chất PH7 và L-valin qua cầu nối ester, cần phải bảo vệ nhóm -NH2 của valin. Một số nhóm bảo vệ NH2 có thể sử dụng là 9-fluorenylmethoxycarbonyl (Fmoc), tert- butoxycarbonyl (Boc), trityl (Trt), allyloxycarbonyl (Alloc) [71]. Trong đó Fmoc, Boc được dùng phổ biến nhất do dễ gắn và dễ loại bỏ chọn lọc bằng dung dịch acid
trifloroacetic (TFA) 20-50% trong dicloromethan hoặc dung dịch acid clohydric 5M, dung dịch acid phosphoric 85%. Trên cơ sở đó chúng tôi lựa chọn nhóm Boc do đã có sẵn tại phòng thí nghiệm (Boc2O) và dễ lựa chọn điều kiện loại bỏ về sau. Cơ chế phản ứng bảo vệ valin bằng Boc như trên Hình 4.10.
![]()
![]()
Hình 4.10. Cơ chế phản ứng tổng hợp N-Boc-valin
Phản ứng được tiến hành trên cơ sở tài liệu của Mishra và các cộng sự (2014) [106], có thay đổi một số điều kiện về thời gian phản ứng (96 giờ so với 12 giờ của tài liệu) và nhiệt độ của phản ứng (đun ~50 °C thay vì nhiệt độ phòng).
Về phản ứng tổng TG3:
Phản ứng được tiến hành theo tài liệu của K.S. Parvathy và cộng sự [128]. Chúng tôi nhận thấy, cần sử dụng dicyclohexylcarbodiimid (DCC) với lượng nhiều hơn so với tài liệu để phản ứng xảy ra hoàn toàn. Tác nhân dicyclohexylcarbodiimid và amin bổ trợ 4-dimethylaminopyridin là những chất dễ hút ẩm, nên cần thực hiện trong dung môi khan để đạt hiệu quả tốt. Ngoài ra, khi làm lạnh cǜng cần chú ý giữ cho môi trường khan, tránh hơi nước ngưng tụ làm hỏng tác nhân DCC. Nhiệt độ không ảnh hưởng đáng kể tới hiệu suất của phản ứng. Tạp dicyclohexylure (DCU) dễ kết tủa trong khối phản ứng, được chúng tôi loại đi bằng cách lọc và xử lý với ethyl acetat.
Về phản ứng tổng hợp PH16
Thủy phân nhóm –Boc có thể dùng một số điều kiện acid như: acid trifluroacetic trong dicloromethan, HCl trong ethyl acetat, H2SO4 trong tert-butyl methyl ester, acid phosphoric trong tetrahydrofuran hoặc các acid Lewis như TiCl4, SnCl4, AlCl3
... TG3 có hai liên kết có thể bị thủy phân là amid và ester. Do đó, cần phải lựa chọn tác nhân thủy phân chọn lọc –Boc (amid) mà không thủy phân chức ester. Dựa trên tài liệu của F. S. Gibson (1994) [54], chúng tôi lựa chọn các điều kiện như sau:
+ Tác nhân thủy phân HClk trong methanol (tài liệu là HClk trong ethyl acetat).
+ Thời gian phản ứng lâu hơn 8-12 giờ (tài liệu 2 giờ).
+ Nhiệt độ của phản ứng là ~ 50 °C (tài liệu là nhiệt độ phòng).
HClk trong methanol có ưu điểm là dễ cất loại sau khi kết thúc phản ứng. Lượng HCl dư được xử lý bằng dung dịch NaHCO3 bão hòa ở pH = 8-9. Sản phẩm được chiết bằng ethyl acetat, sau đó tinh chế bằng sắc ký cột.
4.2. BÀN LUẬN VỀ XÁC ĐỊNH CẤU TRÚC CÁC DẪN CHẤT
![]()
4.2.1. Bàn luận về cấu trúc dẫn chất PH1 và PH2
![]()
Hình 4.11. Cấu trúc PH1, PH2 và các giá trị tín hiệu proton trên phổ 1H-NMR
Theo tài liệu đã công bố năm 2002 [119], sản phẩm thu được từ phản ứng alkyl hóa của curcumin với tác nhân methyl cloroacetat là dẫn chất di-alkyl hóa trên 2 nhóm -OH phenol của curcumin. Tuy nhiên, kết quả phân tích dữ liệu phổ của chúng tôi đã chỉ ra, sản phẩm thu được trong nghiên cứu này là dẫn chất tetra-alkyl hóa (PH1). Cụ thể, phổ ESI-MS của PH1 cho pic ion phân tử [M+Na]+ (m/z = 679,2) và [M-H]- (m/z = 655,2) phù hợp với KLPT curcumin đã bị thế bởi 4 nhóm methoxycarbonylmethyl là 656,64 đvC, tương ứng với CTPT C33H36O14 [Phụ lục 2].
Các liên kết đặc trưng cho khung curcumin và các nhóm thế này cǜng được thể hiện trên phổ IR của PH1, đó là: C-H nhân thơm và nối đôi liên hợp (với ν̅max = 3010 cm-1, cường độ yếu), C-H no (2951 và 2866 cm-1, yếu), C=O ceton (1665 cm- 1, mạnh), C=C thơm (1587 và 1509 cm-1, trung bình), C-O (1259 và 1189 cm-1, mạnh); trong đó không có sự hỗ biến của cấu trúc β-diceton do proton ở C-4 đã bị thế hoàn toàn. Ngoài ra, còn xuất hiện đỉnh hấp thụ đặc trưng của nhóm C=O ester (1741 cm-1, mạnh), chứng tỏ phản ứng ester hóa -OH phenol đã xảy ra [Phụ lục 1].
Trên phổ 1H-NMR của PH1 không quan sát thấy tín hiệu singlet của các nhóm
-OH phenol tự do (với Ł ~ 9,64 ppm) cǜng như của proton tại C-4 (với Ł ~ 3,90 ppm - cho dạng ceto hoặc Ł ~ 6,0 ppm - cho dạng enol) - cǜng chứng tỏ các vị trí