Ng = Ar . P
Ar: số hạt nhân phân rã/s.
P: xác suất phát tia gamma trên một phân rã.
e. Đo mẫu:
- Đặt mẫu vào vị trí đo (tại cùng vị trí đã đo chuẩn để xác định hiệu
suất).
- Tiến hành phép đo với thời gian 12 – 24 giờ (đảm bảo đủ thống kê với độ không đảm bảo tương đối 15%).
- Xử lý phổ: Dùng phần mềm Gammaw để tính toán diện tích tất cả các đỉnh trong một phổ thu nhận bởi hệ phổ kế. Phần mềm này có thể tách được các đỉnh chồng chập một cách hiệu quả, hiển thị phổ, truy xuất dữ liệu đầy đủ thông tin để có thể áp dụng cho các mục đích khác nhau. Phần mềm chỉ áp dụng cho các phổ gamma được thu nhận trên các hệ phổ kế detector bán dẫn với phần mềm đi kèm như sau: Plain vanilla ASCII, Canberra MCA Card, Innovator MCA Crad, AccuSpec Nuclear Data, N66 Nuclear Data, PCA Nuclear, ACE Ortec, Silena, OXAS và Tracor. Ngoài ra, phần mềm còn đáp ứng được tiêu chuẩn khớp số liệu trong việc xây dựng đường cong chuẩn hiệu suất ghi.
- Tính hoạt độ đồng vị phóng xạ 226Ra lấy theo các đỉnh tương ứng sau:
352 keV cho Pb-214,
609, 1 764 keV cho Bi-214.
f. Tính toán kết quả:
- Hoạt độ riêng [11], [46]:
Hoạt độ riêng A (Bq/L) hoặc (Bq/kg) của đồng vị phóng xạ cần phân tích
tại thời điểm đo mẫu là:
S
V Y Pt
Trong đó:
S - số đếm thực của đồng vị phóng xạ cần phân tích tại thời điểm đo mẫu
V- thể tích mẫu (L), hoặc khối lượng mẫu (kg),
- hiệu suất ghi tuyệt đối tại năng lượng đỉnh đang xét,
Y- hiệu suất tách hóa,
P- hiệu suất phát của tia gamma tại năng lượng đỉnh đang xét,
T – thời gian đo mẫu (s).
- Độ không đảm bảo:
2 2
sv
2
y
2
P
2
S V
Y
P
Độ không đảm bảo của hoạt độ riêng A (Bq/L) hoặc (Bq/kg) của một đồng vị phát gamma trong mẫu được tính như sau:
A
Trong đó:
S
s : Độ không đảm bảo tương đối thống kê đếm của hệ đo.
V
v : Độ không đảm bảo tương đối của thể tích hoặc khối lượng trong lấy mẫu.
: Độ không đảm bảo tương đối của hiệu suất tách hóa đồng vị cần phân tích.
y : Độ không đảm bảo tương đối của giá trị hiệu suất ghi lại tại năng lượng E
Y
P
trong việc xây dựng đường chuẩn hiệu suất ghi, bao gồm các thành phần sau: do việc làm khớp đường cong từ phần mềm máy tính thương mại; do giá trị nguồn chuẩn tham khảo để xây dựng đường chuẩn; do việc cân đo của nguồn chuẩn tham khảo để xây dựng đường chuẩn; do tách và/hoặc hòa tan của các nguồn chuẩn hỗn hợp.
: Độ không đảm bảo tương đối do giá trị số liệu hạt nhân.
P
Chương 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Phát triển phương pháp
3.1.1. Chọn đồng vị đánh dấu
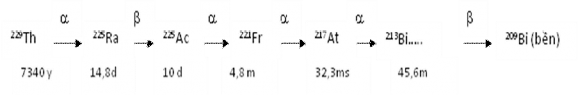
Có ba đồng vị đánh dấu thường được dùng để xác định 226Ra là 223Ra, 224Ra và 225Ra. Trong số đó 225Ra là lý tưởng nhất vì nó không có trong tự nhiên, nên không thể có trong mẫu môi trường được. 225Ra là nguyên tố phát beta có thời gian bán rã là 14,8 ngày, phân rã ra 225Ac có thời gian bán rã là 10 ngày) và tiếp theo là một loạt các đồng vị phát alpha có thời gian bán rã ngắn: 221Fr (T1/2 là 4,8 phút), 217At (T1/2 là 32,3 msec). Trong đó chỉ có 217At thuận lợi nhất cho việc đo vì nó phát alpha ở mức năng lượng 7,07 MeV. Hoạt độ của 225Ac đạt giá
trị cực đại sau 17 ngày kể từ khi điện phân. Tuy nhiên, nếu ta cho chất đánh dấu
225Ra đủ lớn thì cũng có thể đo ngay sau khi điện phân mẫu [51].
Khi yêu cầu xác định hàm lượng cả Th và Ra trong cùng một mẫu thì 229Th được chọn làm chất đánh dấu thuận lợi nhất sau khi 229Th đạt cân bằng với con của nó là 225Ra. Trong bài thí nghiệm này chúng tôi sử dụng 229Th làm chất đánh dấu vì điều kiện phòng thí nghiệm không có đồng vị 225Ra [51].
3.1.2. Điều kiện thí nghiệm
- Thiết bị, dụng cụ: Bếp điện, bình định mức, cốc thuỷ tinh, đũa thuỷ tinh, phễu lọc, giấy lọc, pipette, micropipette, tủ sấy, lò nung, cột trao đổi cation bằng thuỷ tinh - thạch anh, cân phân tích, máy đo pH, hệ điện phân (Hình 3.1), máy nắn dòng, hệ phổ kế alpha: Alpha Analyst 7200.
- Hoá chất:
+ Các loại axit H2SO4 36M; HCl 12M; HNO3 14,5M; HF, HClO4 (PA).
+ Chất đánh dấu 229 Th, có nồng độ 100 mBq/mL.
+ Dung dịch H2O2 30%, NH4OH 25%, Dung môi TBP (PA).
+ Nhựa anion (Bio-Rad AG1-X8, 100-200 mesh, dạng Cl-): ngâm cho nhựa trương trong nước cất và rửa nhựa nhiều lần bằng nước cất trước khi nhồi nhựa vào cột, sau đó rửa bằng 10 mL EDTA 0,1 M (pH = 10).
+ Nhựa cation (Bio-Rad AG50W-X12, 200-400 mesh): ngâm cho nhựa trương trong nước cất, nhồi nhựa vào cột, rửa nhựa bằng nước cất nhiều lần, rửa tiếp với 15 mL CH3COONH4 1,5 M, sau đó rửa bằng 15 mL CH3COONH4 0,2M đã điều chỉnh đến pH = 4,5 với HNO3 trước đó.
+ Dung dịch HNO3 6M; HNO3 0,1 M; HCl 0,1M; HCl 2,5M; HCl 6M;
H2SO4 0,2M.
+ Dung dịch EDTA 0,5M, pH = 10; EDTA 0,1M, pH = 10; CH3COONH4 0,2M; CH3COONH4 1,5M; CH3COONH4 5M; CH3COONH4 0,1M; EDTA 0,005M/CH3COONH4 0,1M; CH3COONH4 1,5M/HNO3 0,1M.
+ Dung dịch KMnO4 0,2 N; MnCl2 0,3M; H2O2 1%/ HCl 1,2M; Pb(NO3)2 0,24M.
Cột trao đổi ion
Bể điện phân (bằng polyethylene)
Bộ phận bảo vệ bằng thép không gỉ
Điện cực platin
Sơ đồ tổng thể
Hình 3.1. Bể điện phân: Bộ phận bảo vệ và điện cực platin.
3.1.3. Các thí nghiệm khảo sát
3.1.3.1 Khảo sát quá trình điện phân:
Theo quy trình của các nước trên thế giới, quá trình điện phân diễn ra trong môi trường rượu propanol, ở cường độ dòng 120mA và thế hiệu 90V. Như đã đề cập ở phần Tổng quan, dụng cụ điện phân này rất khó kiếm trên thị trường, chúng tôi phải tự chế tạo; tuy nhiên, thiết bị điện phân này không đảm bảo an toàn cho người thực hiện, nên chúng tôi tiến hành khảo sát với một số kỹ thuật điện phân trong các môi trường khác nhau nhằm lựa chọn được biện pháp tối ưu
nhất trong việc tạo mẫu đo 226Ra phòng thí nghiệm.
Khảo sát sự điện phân diễn ra với chất đánh dấu Th-229 (đo qua 225Ra/225Ac), hoạt độ ban đầu lúc điện phân là 77,048 mBq/mL; tiến hành theo 3 cách:
+ Điện phân trong rượu propanol với thời gian 1, 2, 3, 4, 5 và 6 giờ.
+ Điện phân trong dung dịch amoni acetat với thời gian 1, 2, 3, 4, 5 và 6 giờ.
+ Điện phân trong dung dịch Na2SO4 với thời gian 1, 2, 3, 4, 5 và 6 giờ. Thủ tục điện phân của cả 3 quy trình như sau:
a) Điện phân trong dung dịch rượu propanol:
+ Làm bay hơi dung dịch chứa rađi đến cạn ở nhiệt độ 70oC.
+ Tan cặn trong 3mL HNO3 0,1M và chuyển vào bể điện phân cùng với 9 mL rượu propanol.
+ Chuyển dung dịch mẫu vào ô điện phân (Hình 3.1), điện phân trên đĩa thép không rỉ với cường độ dòng 120 mA, thế hiệu 90-100V trong thời gian 1, 2, 3, 4, 5 và 6 giờ.
+ Thêm 1 mL NH4OH một phút trước khi dừng điện phân.
+ Rửa đĩa điện phân cẩn thận bằng nước cất, đốt nóng đĩa trên bếp điện trong 5 phút.
+ Chuyển đĩa đã điện phân vào buồng đo của hệ phổ kế alpha, đo trong
thời gian 24 giờ.
b) Điện phân trong dung dịch amoni acetat:
+ Làm bay hơi dung dịch chứa rađi đến cạn khô ở nhiệt độ thấp.
+ Hoà tan cặn rắn bằng 1 mL HNO3 0,1N, chuyển dung dịch vào bể điện phân cùng 10 mL CH3COONH4 0,35 M/HNO3 0,1N, tráng cốc với một lượng tối thiểu dung dịch CH3COONH4 0,35 M/HNO3 0,1N.
+ Lắp điện cực platin vào bể điện phân, nối hai cực với nguồn điện một chiều (xem Hình 3.1), tiến hành điện phân ở cường độ dòng 0,6 A trong 1, 2, 3, 4, 5 và 6 giờ.
+ Thêm 1 mL NH4OH (1+1) vào dung dịch mẫu đang điện phân, giữ 1
phút.
+ Ngắt dòng điện, tháo điện cực platin ra khỏi bể, đổ dung dịch điện phân đi, rửa bể bằng nước cất, sau đó lấy đĩa điện phân ra ngoài.
+ Rửa đĩa điện phân cẩn thận bằng nước cất, đốt nóng đĩa trên bếp điện
trong 5 phút.
+ Chuyển đĩa đã điện phân vào buồng đo của hệ phổ kế alpha, đo trong
thời gian 24 giờ.
c) Điện phân trong dung dịch Na2SO4:
+ Làm bay hơi dung dịch chứa rađi đến cạn khô ở nhiệt độ 70oC.
+ Thêm 10mL axít H2SO4 (1+19), đun nóng để hòa tan cặn. Sau khi làm nguội, thêm 3 giọt chỉ thị thymol blue.
+ Thêm từng giọt NH4OH (1+1), vừa thêm vừa lắc nhẹ cho đến khi màu hồng của chỉ thị thymol blue chuyển sang màu vàng.
+ Thêm từng giọt axít H2SO4 (1+19), vừa thêm vừa lắc nhẹ cho đến khi màu vàng của dung dịch chuyển lại màu hồng nhạt (pH của dung dịch bằng 2).
+ Chuyển dung dịch mẫu vào bể điện phân đã được chuẩn bị sẵn. Tráng cốc bằng nước cất, nước sau khi tráng được dồn chung với dung dịch mẫu để điện phân.
+ Lắp điện cực platin vào bể điện phân, nối 2 cực với nguồn điện 1 chiều (xem Hình 3.1). Tiến hành điện phân ở cường độ dòng 1A trong 1, 2, 3, 4, 5 và 6 giờ.
+ Thêm 1mL NH4OH (1+1) vào dung dịch mẫu đang điện phân, giữ 1
phút.
+ Ngắt dòng điện, tháo điện cực platin khỏi bể, đổ dung dịch điện phân đi,
rửa bể bằng nước cất, sau đó lấy đĩa điện phân ra ngoài.
+ Rửa đĩa điện phân cẩn thận bằng nước cất, đốt nóng đĩa trên bếp điện
trong 5 phút.
+ Chuyển đĩa đã điện phân vào buồng đo của hệ phổ kế alpha, đo trong
thời gian 24 giờ.
Các kết quả khảo sát được trình bày ở Bảng 3.1:
Bảng 3.1. Kết quả khảo sát sự điện phân rađi trong các loại dung dịch: rượu
propanol, amoni acetat và Na2SO4 theo thời gian.
1 | 2 | 3 | 4 | 5 | 6 | |
Số đếm/rượu propanol | 0 | 0 | 7 | 8 | 9 | 8 |
Số đếm/amoni acetat | 0 | 37 | 79 | 92 | 90 | 89 |
Số đếm/ Na2SO4 | 0 | 0 | 2 | 3 | 3 | 2 |
Có thể bạn quan tâm!
-
 Sơ Đồ Tách Và Xác Định 226 Ra Trong Mẫu Nước (Quy Trình Của P. Martin
Sơ Đồ Tách Và Xác Định 226 Ra Trong Mẫu Nước (Quy Trình Của P. Martin -
 Phương Pháp Thu Góp, Bảo Quản Và Xử Lý Mẫu Rong:
Phương Pháp Thu Góp, Bảo Quản Và Xử Lý Mẫu Rong: -
 Ảnh Hưởng Của Khoảng Cách Nguồn Và Detector Đến Sự Thay Đổi Phần Đuôi Năng Lượng Thấp.
Ảnh Hưởng Của Khoảng Cách Nguồn Và Detector Đến Sự Thay Đổi Phần Đuôi Năng Lượng Thấp. -
 Kết Quả Đo 225 Ra/ 225 Ac Hấp Thụ Trên Nhựa Theo Nồng Độ Axit Hcl.
Kết Quả Đo 225 Ra/ 225 Ac Hấp Thụ Trên Nhựa Theo Nồng Độ Axit Hcl. -
 Phổ 226 Ra Trong Mẫu Nước Biển Vĩnh Hải, Thời Gian Đo 48 Giờ.
Phổ 226 Ra Trong Mẫu Nước Biển Vĩnh Hải, Thời Gian Đo 48 Giờ. -
 Sơ Đồ Tách Và Xác Định 226 Ra Trong Mẫu Chuẩn Cỏ Iaea-373.
Sơ Đồ Tách Và Xác Định 226 Ra Trong Mẫu Chuẩn Cỏ Iaea-373.
Xem toàn bộ 168 trang tài liệu này.
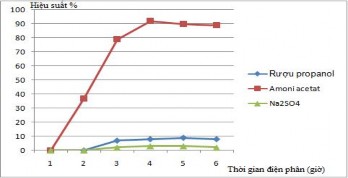
Hình 3.2. Điện phân rađi trong các loại dung dịch: rượu propanol, amoni acetat
và Na2SO4 theo thời gian.
Nhận xét: Từ Bảng kết quả 3.1 và Hình 3.2 về khảo sát sự điện phân rađi trong các loại dung dịch: rượu propanol, amoni acetat và Na2SO4 theo thời gian ta thấy
điện phân rađi trong môi trường amoni acetat, ở cường độ dòng 0,6A trong thời gian 4 giờ cho kết quả tối ưu hơn. Ở đây, khả năng có sự khác nhau về tạo kết tủa bề mặt trong quá trình điện phân; cụ thể: khi sử dụng môi trường amoni acetat để điện phân kết tủa bề mặt tạo ra mỏng hơn trong môi trường Na2SO4,
điều này là do khi điện phân các ion dương sẽ đi về cực âm, như vậy ion NH4+
cùng ion Ra2+ (trường hợp của amoni acetat) và ion Na+ cùng ion Ra2+ (trường hợp của Na2SO4) sẽ đi về cực âm và tạo kết tủa trên bề mặt của đĩa điện phân (đĩa thép không rỉ), sau khi điện phân xong, đĩa được đốt trên ngọn lửa đèn cồn, lúc này ion NH4+ sẽ bay hơi, trong khi ion đó ion Na+ không bay hơi, nên lớp tủa sẽ dày hơn và làm giảm hiệu suất ghi khi đo trên hệ phổ kế alpha. Trong thí nghiệm này không so sánh với điện phân trong rượu propanol là do thiết bị điện phân có thể tự chế tạo nên không chuẩn, dẫn đến hiệu suất điện phân thấp.
Kỹ thuật điện phân rađi trong môi trường amoni acetat sẽ được áp dụng để khảo sát sự hấp thụ của Ra trên nhựa cation theo nồng độ HCl khác nhau tiếp theo.
3.1.3.2. Khảo sát sự hấp thụ của Ra trên nhựa theo nồng độ HCl:
Theo sơ đồ trên Hình 3.3.
Cột trao đổi Cation
- Rửa nhựa bằng nước cất nhiều lần.
- Rửa nhựa bằng 10 mL HCl 1N
- Dội qua cột dd chứa 100 mBq 229Th trong HCl 1N
- Rửa cột với 10 mL HCl 1N (5 mL/lần)
Dung dịch (bỏ)
Giải hấp Ra với 25 mL HCl 12N
Dung dịch giải hấp chứa Ra
- Cô cạn
- Điện phân theo quy trình Amoni Acetat trong 4 h
Đo bằng hệ phổ kế Alpha
Hình 3.3. Sơ đồ khảo sát sự hấp thụ của Ra trên nhựa theo nồng độ HCl.






