Khi nghiên cứu về đặc điểm sắc tố và phức hệ quang hợp giữa các loài PNSB khác nhau mà lại có sự giống nhau cho thấy khả năng quang dưỡng ở PNSB là do chuyển gene ngang. Nghiên cứu của Nagashimi và cộng sự, 1997 về phức hệ quang hợp protein đơn đã chứng minh điều này [11].
Hơn 25 chi VKTQH đa dạng về hình thái đã được công bố (Bảng 1.1). VKTQH bao gồm cả các loài có khả năng hình thành hạt lưu huỳnh bên trong tế bào (họ Chromatiaceae) và các loài có khả năng hình thành hạt lưu huỳnh bên ngoài tế bào (họ Ectothiorhodospiraceae).
Bảng 1.1. Các chi vi khuẩn tía quang hợp [5]
Chi | Viết tắt tên chi1 | Hình thái | |
Alphaproteobacteria | Rhodobaca 3 | Rca. | Hình cầu hoặc que ngắn |
Rhodobacter | Rba. | Hình que | |
Rhodovulum | Rdv. | Hình cầu hoặc que | |
Rhodopseudomonas3 | Rps. | Hình que có nảy chồi | |
Rhodoblastus3 | Rbl. | Hình que có nảy chồi | |
Blastochloris | Blc. | Hình que có nảy chồi | |
Rhodomicrobium | Rmi. | Hình que có nảy chồi | |
Rhodobium | Rbi. | Hình que | |
Rhodoplanes | Rpl. | Hình que | |
Rhodocista3 | Rcs. | Dạng sợi | |
Rhodospirillum | Rsp. | Dạng sợi | |
Phaeospirillum | Phs. | Dạng sợi | |
Rhodopila3 | Rpi. | Hình cầu | |
Rhodospira | Rsa. | Dạng sợi | |
Rhodovibrio3 | Rhv. | Hình dấu phẩy | |
Rhodothallasium | Rts. | Dạng sợi | |
Roseospira | Ros. | Dạng sợi | |
Roseospirillum | Rss. | Dạng sợi | |
Betaproteobacteria | Rhodocyclus | Rcy. | Hình dấu phẩy tròn |
Rhodoferax3 | Rfx. | Hình que, dấu phẩy | |
Rubrivivax | Rvi. | Hình que, phẩy tròn |
Có thể bạn quan tâm!
-
 Nghiên cứu khả năng phân hủy hydrocarbon dầu mỏ của một số chủng vi khuẩn tía quang hợp tạo màng sinh học phân lập tại Việt Nam - 1
Nghiên cứu khả năng phân hủy hydrocarbon dầu mỏ của một số chủng vi khuẩn tía quang hợp tạo màng sinh học phân lập tại Việt Nam - 1 -
 Nghiên cứu khả năng phân hủy hydrocarbon dầu mỏ của một số chủng vi khuẩn tía quang hợp tạo màng sinh học phân lập tại Việt Nam - 2
Nghiên cứu khả năng phân hủy hydrocarbon dầu mỏ của một số chủng vi khuẩn tía quang hợp tạo màng sinh học phân lập tại Việt Nam - 2 -
 Ứng Dụng Của Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ
Ứng Dụng Của Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ -
 Ứng Dụng Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ
Ứng Dụng Vi Khuẩn Tía Quang Hợp Để Phân Hủy Hydrocarbon Dầu Mỏ -
 Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án
Sơ Đồ Các Bước Thí Nghiệm Thực Hiện Trong Luận Án
Xem toàn bộ 144 trang tài liệu này.
Chi | Viết tắt tên chi1 | Hình thái | |
Gammaproteobacteria | |||
Họ Chromatiaceae2 | Allochromatium | Alc. | Hình que |
Amoebobacter | Amb. | Hình cầu | |
Chromatium | Chr. | Hình que | |
Halochromatium3 | Hch. | Hình que | |
Isochromatium | Isc. | Hình que | |
Lamprobacter | Lpb. | Hình que | |
Lamprocystis | Lpc. | Cụm hình cầu | |
Marichromatium | Mch. | Hình que | |
Rhabdochromatium | Rbc. | Hình que | |
Thermochromatium3 | Tch. | Hình que | |
Thioalkalicoccus3 | Tac. | Hình cầu | |
Thiobaca | Tba. | Hình que | |
Thiocapsa | Tca. | Hình cầu | |
Thiococcus | Tco. | Hình cầu | |
Thiocystis | Tcs. | Hình cầu đến que ngắn | |
Thiodictyon | Tdc. | Tập hợp hình que | |
Thiofl avicoccus | Tfc. | Hình cầu | |
Thiohalocapsac3 | Thc. | Hình cầu | |
Thiolamprovum | Tlp. | Hình cầu | |
Thiopedia | Tpd. | Hình cầu, dạng đĩa | |
Thiorhodococcus | Trc. | Hình cầu | |
Thiorhodovibrio | Trv. | Hình dấu phẩy dạng sợi | |
Thiospirillum | Tsp. | Dạng sợi | |
Họ Ectothiorhodo- spiraceae2 | Ectothiorhodospira3 | Ect. | Hình dấu phẩy dạng sợi |
Halorhodospira3 | Hlr. | Hình dấu phẩy dạng sợi | |
Thiorhodospira3 | Trs. | Hình dấu phẩy dạng sợi | |
Ectothiorhodosinus | Ets. | Hình que |
Ghi chú: 1 - Viết tắt theo Imhoff và Madigan (2004) [12]; 2 - Các loài thuộc họ Chromatiaceae tích luỹ lưu huỳnh từ quá trình oxy hóa sulfide nội bào (Hình 1.1a); các loài thuộc họ Ectothiorhodospiraceae không tích luỹ lưu huỳnh; 3 - Chứa một hoặc nhiều loài phát triển ở nhiệt độ, độ pH, hoặc độ mặn lớn hơn độ mặn của biển.
Ngày nay, với sự đa dạng của nhóm VKTQH bên cạnh việc phân tích thông tin di truyền gen 16S rDNA, người ta còn phát hiện ra gen pufM có tính bảo thủ cao để phân loại và đánh giá nhanh sự có mặt của nhóm VKTQH.
Gen pufM thuộc operon puf (photosynthetic unit forming) được tìm thấy trong nhóm vi khuẩn quang hợp không thải oxy thuộc phân lớp Alpha-, Beta- và Gammaproteobacteria và họ Cloroflexaceae. Hiện nay, người ta phát hiện ra 5 loại operon puf khác nhau. Trong tất cả VKTQH đều chứa pufBALM mã hóa cho tiểu phần L và M của protein trong tâm phản ứng quang hợp. Ở VKTQH tâm phản ứng gồm ba tiểu phần, L (light), M (medium) và H (heavy). Chúng có chức năng gắn với bacteriochlorophyll và carotenoid cũng như quinone và được tách ra nguyên vẹn như là một phức hợp sắc tố - protein riêng biệt. Gen pufL và pufM có mặt trong tất cả các loại operon puf, chúng có vai trò quan trọng trong quá trình sinh trưởng quang dưỡng. Hiện nay, hai gen pufL và pufM đang được quan tâm khi nghiên cứu nhóm VKTQH ở cấp độ phân tử. Đặc biệt, gen pufM mã hóa cho tiểu phần M của protein liên kết với sắc tố trong tâm phản ứng quang hợp được nhiều nhóm tác giả sử dụng khi nghiên cứu VKTQH. Gen pufM có tính bảo thủ cao, sản phẩm PCR gen pufM có kích thước khoảng 200 bp, dễ dàng phân tích trình tự và so sánh. Ngoài việc dùng gen pufM để phân loại nhóm vi khuẩn này người ta còn sử dụng như một công cụ cho việc phát hiện khả năng sinh sống trong cả điều kiện môi trường thuận lợi và khắc nghiệt [13].
1.1.3.3. Đa dạng về các phương thức trao đổi chất
Hai nhóm PSB và PNSB được minh chứng có sự khác nhau dựa trên cơ sở trao đổi chất và phát sinh loài, nhưng các loài thuộc hai nhóm này thường cùng tồn tại trong môi trường kỵ khí được chiếu sáng trong tự nhiên. PSB có khả năng quang tự dưỡng rất cao và có khả năng quang hóa ở mức hạn chế, nhưng chúng lại ít có khả năng trao đổi chất và tăng trưởng trong bóng tối. Ngược lại, PNSB tồn tại trong dải ánh sáng rộng, vừa có khả năng quang tự dưỡng và vừa có khả năng đa dạng cho sự trao đổi chất và tăng trưởng tối [5]. Trong phạm vi đề tài này, chúng tôi chủ yếu đề cập tới nhóm PNSB.
Nhóm PNSB phân bố rất rộng rãi trong tự nhiên. Một vài loài PNSB có thể sinh trưởng kỵ khí trong tối bằng phương thức lên men hoặc hô hấp kỵ khí và hầu hết chúng có thể sinh trưởng hô hấp hiếu khí trong tối. Trong các điều kiện này,
chất cho điện tử có thể là hợp chất hữu cơ hoặc vô cơ như H2. Tuy nhiên, khả năng sinh trưởng chủ yếu của PNSB là quang hợp dị dưỡng, trong đó ánh sáng là nguồn năng lượng và một hợp chất hữu cơ là nguồn carbon [2, 3].
PNSB có tính linh hoạt đặc biệt trong các phương thức dinh dưỡng và sử dụng các nguồn năng lượng. Chúng có thể sử dụng các acid béo, đường, rượu và cả các hợp chất thơm là nguồn carbon. Phần lớn PNSB có thể sinh trưởng quang tự dưỡng với CO2 + H2 hoặc CO2 + H2S ở nồng độ thấp. Rất nhiều hợp chất thơm được sử dụng bởi các VK này bao gồm các chất được tạo thành từ quá trình phân hủy kỵ khí lignin cũng như những sản phẩm tổng hợp độc hại tích tụ trong môi trường. Chúng có khả năng đồng hóa hầu như hoàn toàn nguồn carbon từ một số cơ chất thơm thành sinh khối tế bào của mình [3]. Vì các hợp chất thơm ở trạng thái bị khử hơn các vật liệu của tế bào nên VK phân hủy hợp chất thơm trong điều kiện quang hợp cần sự đồng hóa CO2 ở một mức độ nhất định để làm cân bằng thế oxy hóa khử của chúng. Ví dụ như oxy hóa benzoate ở VKTQH xảy ra theo các phương trình sau:
C7H6O2 + 6 H2O 3 CH3COOH + CO2 + 6 [H] 6[H] + 1,5 CO2 1,5 [CH2O] +1.5 H2O
Ngoài ra, nhiều quá trình chuyển hóa carbon của PNSB đã được nghiên cứu và công bố. Đồng thời, vai trò cố định nitơ của PNSB cũng đã được biết đến. Rba. capsulatus và Rba. sphaeroides có thể sinh trưởng nhanh chóng với N2 là nguồn N với hoạt tính của enzyme nitrogenase tăng mạnh. Do đó, đây là nhóm VKTQH có nhiều hướng ứng dụng khác nhau, có thể liệt kê đến như là sinh vật mô hình để nghiên cứu các quá trình quang hợp không thải oxy, ứng dụng trong xử lý các nguồn ô nhiễm hữu cơ [10].
1.1.4. Đặc điểm của bộ máy quang hợp
VKTQH chỉ có một hệ thống quang hóa với một trung tâm phản ứng, do đó sự vận chuyển điện tử của chúng rất khác biệt so với mạch truyền điện tử ở thực vật (có ít nhất hai hệ quang hóa với hai trung tâm phản ứng) [14]. Phương trình tổng quát: CO2 + 2H2A + hv [CH2O]n + 2A + H2O
Chú thích: Ở tảo và thực vật bậc cao: H2A chính là H2O. Ở VKTQH: H2A có thể là một số chất như lưu huỳnh, các hợp chất khử của lưu huỳnh, hydro phân tử hoặc các hợp chất hữu cơ đơn giản. Trong đó, các chất hữu cơ vừa đóng vai trò làm chất cho điện tử vừa làm nguồn carbon trong quá trình quang hợp.
1.1.4.1. Sắc tố quang hợp
Bacteriochlorophyll (Bchl)
Sắc tố quang hợp chính ở VKTQH là bacteriochlorophyll (Bchl). Dựa theo sự khác nhau về cấu trúc phân tử và cực đại hấp thụ trong vùng ánh sáng đỏ, Bchl được chia thành 5 nhóm a, b, c, d, e. Đa số các loài VKTQH chứa Bchl a, trừ một số loài như Rps. sulfoviridis, Rps. viridis… lại chứa chủ yếu là Bchl b [14].
Carotenoid
Ngoài bacteriochlorophyll, VKTQH còn chứa các carotenoid. Thành phần carotenoid ở VKTQH rất đa dạng và phong phú, có thể chia thành một số nhóm như: Rhodopinal, sphaeroidenone, spirilloxanthinin, okenonene.
1.1.4.2. Màng quang hợp
Các thành phần của hệ thống quang hợp tương tác với nhau và định vị ở phía trong màng tế bào tạo thành màng quang hợp. Khi lượng sắc tố quang hợp trong tế bào cao sẽ dẫn đến hiện tượng màng gập lại. Các kiểu gập khác nhau mang tính đặc trưng cho loài và được chia thành các dạng: lớp mỏng (lamellar), dạng ống (tubular) hay dạng bóng túi (vescicular) [15].
1.1.4.3. Định vị sắc tố quang hợp trong tế bào vi khuẩn tía quang hợp
Sắc tố quang hợp nằm ở đơn vị quang hợp. Đơn vị này phân bố trên hệ màng của bộ máy quang hợp (chromotophor).
1.1.4.4. Đơn vị quang hợp
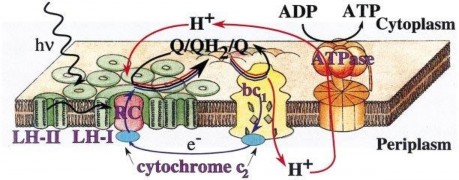
Hình 1.2. Sơ đồ vị trí các thành phần của bộ máy quang hợp sơ cấp ở VKTQH [16]
Đơn vị quang hợp gồm sắc tố anten LH-I và LH-II (để thu nhận ánh sáng), trung tâm phản ứng của quang hệ (kí hiệu là P) đây là Bchl nhưng ở trạng thái dimer. Chúng gắn kết chất cho và chất nhận điện tử sơ cấp tạo thành trung tâm phản ứng của quang hệ (RC). Đơn vị quang hợp nằm trên màng quang hợp (Hình 1.2).
1.1.4.5. Hoạt động của bộ máy quang hợp sơ cấp
Ánh sáng được tế bào thu nhận qua hệ thống anten. Từ đây năng lượng được chuyển vào trung tâm phản ứng (bao gồm 4 phân tử Bchl, 2 phân tử bacteriophaeophintin và 1 phân tử protein). Khi trung tâm phản ứng P870 được kích thích quá trình phân chia điện tích được xảy ra. Điện tử được truyền đến chất nhận sơ cấp (Bchl-BPheo) ngược chiều nhiệt động học. Từ đó điện tử di chuyển đến các quinon rồi qua một chuỗi vận chuyển electron lại trở về P870 đồng thời ATP được tổng hợp (Hình 1.3).
Để tạo ra các hợp chất khử (NADH), VKTQH cần có chất cho điện tử từ bên ngoài. Nhờ có năng lượng và chất khử, dòng điện tử di chuyển đi ngược feredoxin để tạo NADH từ NAD+. VKTQH có thể sản xuất ra một lượng lớn NAD+ trong quá trình quang hợp để sử dụng trong cố định CO2.
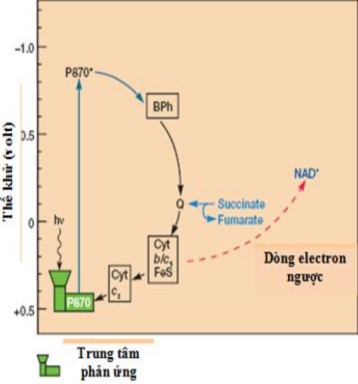
Hình 1.3. Quang hợp ở VKTQH không lưu huỳnh [17]
Chú thích: P870: Trung tâm phản ứng; Cyt: cytochrom; Bph: Bacteriopheophytin)
1.1.5. Dinh dưỡng carbon
1.1.5.1. Quá trình cố định CO2
PNB và PNSB đều có khả năng cố định CO2 giống như vi tảo và các thực vật bậc cao khác. Con đường chính để chúng cố định CO2 là chu trình pentose phosphate khử Calvin-Benson-Bassham (CBB hay còn gọi là chu trình Calvin), với enzyme ribulose-1,5-bisphosphate carboxylase / oxygenase (RubisCO) là chất xúc tác phản ứng. Đây là enzyme chìa khóa của chu trình Calvin. Enzyme này hoạt động mạnh nhất khi tế bào sinh trưởng ở điều kiện tự dưỡng ngoài sáng. Khi tế bào VKTQH sinh trưởng ở điều kiện quang dị dưỡng, sự tổng hợp enzyme này bị kìm chế [18].
Ngoài khả năng cố định CO2, VKTQH còn có khả năng đồng hóa các hợp chất hữu cơ như: hợp chất 1-C; 2-C; 3C; 4-C và đường (6C).
1.1.5.2. Quang hợp dị dưỡng (nguồn carbon)
+ Hợp chất 1-C (formate, methanol, CO)
Có nhiều ví dụ về khả năng VKTQH sử dụng hợp chất 1 carbon cho sinh trưởng ví dụ như: loài Rhodopila globiformis có khả năng sử dụng CO và methanol; loài Rps. palustris có khả năng sinh trưởng trong môi trường chứa formate khi được chiếu sáng. Nhờ enzyme formate-dehydrogenaza mà formate bị oxy hóa thành CO2, sau đó CO2 này lại được đồng hóa theo chu trình Calvin, loài Rhodocyclus gelatinosa và Rps. acidophila có khả năng sử dụng methanol làm nguồn carbon cho sinh trưởng khi được chiếu sáng tuy nhiên trong điều kiện đòi hỏi phải được cung cấp thêm CO2 với vai trò làm chất nhận điện tử. Ở điều kiện sinh trưởng này, mức độ enzyme RubisCO trong tế bào tăng lên 6 lần so với khi sinh trưởng trên môi trường chỉ chứa succinate làm cơ chất duy nhất. Chu trình Calvin còn có vai trò vận chuyển sức khử dư thừa từ methanol tới CO2. Như vậy, RubisCO vừa đóng vai trò là enzyme chìa khóa quan trọng trong quá trình đồng hóa CO2 lại vừa có vai trò giữ thế cân bằng oxy hóa khử [18, 19].
+ Hợp chất 2-C (acetate)
Tất cả các đại diện của nhóm VKTQH đã biết đều có khả năng sinh trưởng trên môi trường chứa acetate, có ánh sáng. Khả năng đồng hóa acetate rất khác nhau
ở các chủng khác nhau. Enzyme chìa khóa của chu trình glyoxylate là isocitrate lyase (ICL). Hoạt tính enzyme ICL trong dịch chiết từ tế bào các loài Rhodospirillum (Rsp.). palustris và Rba. capsulatus khi chúng sinh trưởng trên môi trường chứa acetate hay butyrate ở điều kiện quang dưỡng cũng như hóa dưỡng là khá cao. Những bằng chứng về sự tồn tại của enzyme ICL trên đây cho thấy acetate được PNSB đồng hóa theo chu trình glyoxylate. Ngoài chu trình glyoxylate, một số nghiên cứu gần đây đã phát hiện con đường khác có thể đồng hoá acetate [20, 21].
+ Hợp chất 3-C (pyruvate, propionate, glycerol, aceton).
Ở ngoài sáng, tất cả các vi khuẩn quang hợp đều có khả năng sinh trưởng trên môi trường chứa pyruvate theo kiểu quang dị dưỡng. Sự đồng hóa pyruvate và hệ thống tham gia quá trình này khác nhau đối với mỗi loài. Đa số các loài đều chứa enzyme pyruvate dehydrogenase. Một số loài khi sinh trưởng ngoài sáng có thể phân hủy pyruvate tới CO2, axetaldehyde và acetoin nhờ enzyme pyruvate decarboxylase. Các tế bào Rsp. rubrum sử dụng cả hai enzyme PEP–synthase (phosphate enol pyruvate synthase) và PEP-cacboxylaza để chuyển hóa pyruvate và tạo thành axit oxaloacetate (OAA). Các tế bào loài Rba. sphaeroides và Rba. capulatus không chứa hai enzyme trên, chúng sử dụng pyruvate nhờ sự xúc tác của enzyme pyruvate carboxylase (PC). Ở tế bào loài Rsp. rubrum, Rba. sphaeroides và Rba. capsulatus, enzyme pyruvate kinase (PK) tham gia cùng với enzyme PEP- carboxykinase xúc tác phản ứng tạo phosphoenolpyruvate từ pyruvate. Loài Rsp. rubrum còn có khả năng lên men pyruvate trong tối, sản phẩm của quá trình này là propionate, H2 và formate. Formate lại được chuyển hóa tiếp tục để tạo ra CO2 và H2 [22, 23].
PNSB còn có khả năng sử dụng các chất 3-C khác như propionate, glyxerol, axeton. Trong những trường hợp này cần phải bổ sung thêm CO2 (chất nhận điện tử) để giữ thế cân bằng oxy hóa khử của tế bào [4, 24].
+ Butyrate và các axit béo dạng khử
Các PNSB sinh trưởng nhanh hơn và đạt mật độ cao hơn trong môi trường có các cơ chất 4-C với hai nhóm carboxyl (như malate, succinate) so với khi sinh trưởng trên các nguồn cơ chất khác.





