Trong tổng cộng 6 giờ đầu chất mang giải phóng 65,29% lượng thuốc được mang trong hệ PNS@CS-PEG ở môi trường pH 4,5. Cũng trong 6 giờ đầu nhưng trong môi trường pH 7,4 lượng thuốc phóng tích là 35,56%. Vậy bước đầu cho thấy thuốc giải phóng tốt trong môi trường pH 4,5 (gần giống với pH của tế bào ung thư).
Trong khoảng từ 6 giờ đến 96 giờ chất mang giải phóng được 76,73 % tại pH 4.5 trong khi tại pH 7,4 thì 42,28%. Ta thấy, thuốc sẽ giải phóng nhiều ở điều kiện pH 4.5 (gần giống pH của tế bào ung thư). Bên cạnh đó, chất mang PNS@CS-PEG còn có liên kết disulfide liên kết này rất bền trong môi trường trung tính (môi trường tế bào lành) nhưng trong môi trường của tế bào ung thư thì hàm lượng gluthathione cao rất nhiều sẽ phá vỡ cầu nối SS giải phóng tại tế bào ung thư một cách hiệu quả [93, 94].
Các hệ biến tính PNS tạo ra các chất mang thuốc 1 (PNS-GPTMS-Hydrazine), chất mang thuốc 2 (PNS-GPTMS-CS-mPEG), chất mang thuốc 3 (PNS-APTES), chất mang thuốc 4 (PNS-APTES-COOH-GE), chất mang thuốc 5 (PNS-GEL-mPEG) đều giữ chặt thuốc 5-FU trong hệ do tương tác tĩnh điện giữa thuốc và chất mang và không giải phóng được 5-FU trong cả 2 môi trường acid và trung tính nên khi tổng hợp chất mang thuốc 6 (PNS@CS-PEG) chúng tôi không tiến hành giải phóng 5-FU trong trường hợp này.
3.3.8. Nhận xét chung cho tất cả các kết quả mang và giải phóng thuốc
Sau khi khảo sát hiệu suất mang thuốc, khả năng mang giải phóng thuốc của hệ PNS chưa biến tính và hệ PNS biến tính qua các cấp độ khác nhau chúng ta nhận thấy rằng hệ biến tính PNS-APTES-Anhydrid Succinic- Gelatin-mPEG (gọi tắt là PNS-GEL-mPEG) cho hiệu suất mang thuốc DOX cao nhất (85,88 ± 1,15%). Bên cạnh đó hệ PNS-GPTMS-CS- mPEG cũng cho hiệu suất mang thuốc DOX khá cao so với nhưng nghiên cứu trước kia. Lý giải cho kết quả khả quan này là dựa vào liên kết imine của thuốc DOX và chất mang.
Sự hình thành liên kết imine (hay còn gọi liên kết bazơ Schiff) giữa DOX và chất mang trên cơ sở như sau:
Trong cấu trúc hóa học của thuốc DOX có nhóm NH2 (nhóm amino) đây là một nhóm hoạt hóa khá mạnh do có đôi điện tử linh hoạt (tự do) dễ dàng cho điện tử vào những tâm thiếu điện tử. Hai hệ biến tính lên nano silica xốp (PNS) được chọn là hệ (CS-mPEG và GEL-
mPEG) đều có nhóm ( ) thiếu điện tử dễ dàng nhận điện tử từ nhóm NH2 của thuốc DOX tạo thành liên kết imine giữa chất mang thuốc và DOX. Và một điều thú vị nữa
96
trên tất cả các hệ biến tính như chitosan và gelatin cũng nhóm NH2 sẽ sẵn sàng tạo liên kết
imine ngược lại với nhóm ( ) có trong cấu trúc hóa học của DOX [22, 95]. Nhờ vào liên kết imine kép giữa chất mang và thuốc DOX nên hai hệ PNS biến tính bằng CS- mPEG và GEL-mPEG cho hiệu suất khá cao so với các hệ mang thuốc khác [96, 97].
Đối với hệ mang thuốc biến tính hydrazine thì tạo liên kết hydrazon với DOX. Qua tìm hiểu chúng tôi được biết rằng liên kết imine và hydrazon rất có ý nghĩa trong y học dẫn truyền thuốc vì cả hai liên kết này đều bền trong môi trường trung tính của tế bào lành (pH 7,4) và khi đến gần tế bào ung thư pH thấp khoảng 4,5 sẽ phá vỡ liên kết và giải phóng thuốc đúng mục tiêu[26, 98, 99].
Qua bảng 3.22 nhận thấy rằng, hệ PNS-APTES-COOH-GEL-mPEG (viết tắt PNS- GEL-mPEG) là hệ có hiệu suất mang thuốc khá cao nhờ có liên kết imine kép bền vững với DOX và cũng nhờ liên kết imine nên hệ có tỷ lệ nhả thuốc khá tốt trong môi trường pH 4,5 và nhả chậm trong môi trường pH 7,4.
Bảng 3.22. So sánh hiệu suất mang thuốc và khả năng giải phóng thuốc DOX của PNS và các hệ PNS biến tính
DLE(%) | DLC(%) | Tỷ lệ giải phóng thuốc DOX sau 96 giờ (%) | ||
pH 7,4 | pH 4,5 | |||
PNS-APTES-COOH-GEL- mPEG với thuốc DOX | 85,88 ± 0,15 | 17,64 ± 0,02 | 33,30 | 75,09 |
PNS-GPTMS-CS-mPEG với thuốc DOX | 71,75 ± 1,89 | 12,55 ± 0,27 | 30,22 | 70,65 |
PNS-GPTMS-Hydrazine mang DOX | 61,60 ± 1,05 | 9,98 ± 0,30 | 27,69 | 74,09 |
PNS@CS-PEGmang DOX | 57,81± 1,45 | 11,79 ± 0,29 | 42,28 | 76,73 |
PNS-APTES-COOH-GE với thuốc DOX | 55,9 ± 1,72 | 10.06 ± 0,32 | 26,57 | 67,51 |
PNS-APTESmang DOX | 54,03 ± 2,41 | 7,40 ± 0,43 | 54,86 | 80,32 |
PNS mang thuốc DOX | 23,01 ± 2,16 | 2,09 ± 0,32 | 90,00 | 95,09 |
Có thể bạn quan tâm!
-
 Kết Quả Giải Phóng Thuốc 5-Fu Của Pns (Nano Silica Xốp)
Kết Quả Giải Phóng Thuốc 5-Fu Của Pns (Nano Silica Xốp) -
 Phổ Hplc Của 5-Fu (A) Và Hplc Của Hệ Pns-Gptms-Cs-Mpeg Mang 5-Fu Giải Phóng (B)
Phổ Hplc Của 5-Fu (A) Và Hplc Của Hệ Pns-Gptms-Cs-Mpeg Mang 5-Fu Giải Phóng (B) -
 Phổ Hplc Của 5-Fu (A) Và Hplc Của Hệ Pns-Aptes-Cooh-Ge
Phổ Hplc Của 5-Fu (A) Và Hplc Của Hệ Pns-Aptes-Cooh-Ge -
 Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 16
Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 16 -
 Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 17
Nghiên cứu biến tính bề mặt nano silica làm chất mang thuốc chống ung thư - 17
Xem toàn bộ 137 trang tài liệu này.
Qua bảng 3.23 nhận thấy hệ PNS-GPTMS-CS-mPEG mang thuốc 5-FU hiệu quả nhất do tương tác tĩnh điện giữa chất mang và thuốc tuy nhiên với cách mang thuốc nén chặt vào vật liệu thì hệ không thể giải phóng được thuốc. Nhưng nếu mang thuốc theo cách thông thường giống như mang DOX thì thuốc không vào vật liệu. Vậy vật liệu nano silica xốp biến tính cho hiệu quả khá cao đối với DOX nhưng không phù hợp với 5-FU.
Bảng 3.23. So sánh hiệu suất mang thuốc và khả năng giải phóng 5-FU của PNS và các hệ PNS biến tính
DLE (%) | DLC(%) | Tỷ lệ giải phóng thuốc DOX sau 96 giờ (%) | ||
pH 7,4 | pH 4,5 | |||
PNS-GPTMS-CS- mPEG mang 5-FU | 70,04 ± 2,60 | 14,38 ± 0,50 | 0 | 0 |
PNS-APTES-Ge-mPEG mangthuốc 5-FU | 63,33 ± 1,12% | 13,10± 0,32% | 0 | 0 |
PNS-GPTMS- Hydrazine mang 5-FU | 22,60 ± 1,27 | 5.35± 0.16 | 0 | 0 |
PNS-APTES-COOH- GE mangthuốc 5-FU | 20,41± 1,35 | 5,35± 0.21 | 0 | 0 |
PNS-APTES mang 5- FU | 19,53 ± 1,20 | 4,65 ± 0,19 | 0 | 0 |
PNS mang 5-FU | 15,60 ± 1,85 | 3,75 ± 0,12 | 0 | 0 |
3.4. Kết quả thử độc tính tế bào
Từ bảng kết quả 3.23 sau khi khảo sát hiệu quả mang và giải phóng thuốc của các hệ nano silica biến tính, nhận thấy hệ PNS-APTES-COOH-GE mang DOX có tỷ lệ giải phóng thuốc ở tế bào lành (pH 7,4) là thấp nhất nên chọn để đánh giá độc tính tế bào.
Hệ PNS-APTES-COOH-GE (chất mang rỗng); DOX@ PNS-APTES-COOH-GE (PNS-
APTES-COOH-GE mang DOX) và DOX tự do được thử nghiệm độc tính trên các dòng tế bào Hela (ung thư cổ tử cung), MCF-7 (ung thư vú) và Fibroblast (nguyên bào sợi) [100].
Kết quả khảo sát tính tương hợp sinh học trên cơ sở đo độc tính tế bào được thực hiện tại Phòng thí nghiệm Sinh học Phân tử-Bộ môn Di truyền-ĐHKHTN Tp.HCM theo phương pháp nhuộm SRB.
Bảng 3.24. Giá trị IC50 của chất mang DOX và DOX tự do trên các dòng tế bào
Mẫu | Giá trị IC50 (µg/mL) | ||||
Lần 1 | Lần 2 | Lần 3 | TB±ĐLC | ||
MCF-7 | DOX | 0,061 | 0,063 | 0,061 | 0,062±0,001 |
DOX @PNS-APTES-COOH-GE | 26,82 | 31,56 | 23,13 | 27,17±4,23 | |
Hela | DOX | 1,912 | 1,789 | 2,028 | 1,91±0,12 |
DOX @PNS-APTES-COOH-GE | >100 | ||||
Fibroblast | DOX | 1,21 | 1,18 | 1,14 | 1,17±0,04 |
DOX @PNS-APTES-COOH-GE | >100 | ||||
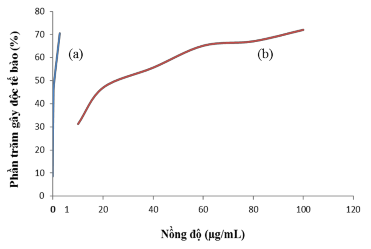
Hình 3.41. Hoạt tính ức chế tế bào MCF-7(ung thư vú) của (a) DOX và (b) PNS-APTES- COOH-GE mang DOX
Nhận xét:
Qua kết quả thử nghiệm độc tính tế bào (bảng 3.23 và hình 3.41) của hệ PNS-APTES- COOH-GE mang DOX, ta nhận thấy hệ mang thuốc không gây độc tế bào lành (Fibrolast), gây độc tế bào ung thư vú (MCF-7) với giá trị IC50 là 27,17±4,23 (µg/mL).
Kết quả bảng 3.24 thỏa mãn phần nào mục tiêu đặt ra là hệ mang thuốc phải an toàn tuyệt đối với tế bào lành và chỉ gây độc đối với tế bào ung thư. Tuy nhiên hệ PNS-APTES- COOH-GE mang DOX vẫn chưa gây độc đối với tế bào ung thư cổ tử cung (Hela), để khắc
phục vấn đề này chúng ta có thể thay đổi tỷ lệ thuốc và chất mang hoặc tăng lượng gelatin khi biến tính nhằm tăng lượng thuốc được mang.
CHƯƠNG 4: KẾT LUẬNVÀ KIẾN NGHỊ
4.1. Kết luận
- Tổng hợp được hạt nano silica cấu trúc xốp, được chứng minh qua các phương pháp TEM, XRD, FTIR. Khảo sát kích thước hạt bằng TEM kết quả cho thấy kích thước hạt nano silica (PNS) dao động trong khoảng 50-60 nm.
- Đã biến tính được vật liệu PNS bằng Hydrazine, Chitosan-mPEG, Gelatin-mPEG và thành phần cấu trúc được xác định bởi các phương pháp FTIR, TGA...
- Khảo sát kích thước hạt PNS sau biến tính bằng TEM kết quả cho thấy kích thước hạt dao động trong khoảng 60-70 nm đạt yêu cầu mang thuốc.
- Khảo sát khả năng mang và giải phóng DOX của hạt sau biến tính bằng phương pháp đo UV-VIS cho thấy hiệu suất mang thuốc khá cao và khả năng giải phóng thuốc ở môi trường tế bào ung thư trong 96 khá tốt đặc biệt nhất là vật liệu nano silica biến tính bằng Ge-mPEG (hệ PNS-APTES-COOH-GEL-mPEG đạt khả năng mang 85,92%) và giải phóng rất ít ở pH 7,4 nhưng giải phóng từ từ và giải phóng lượng nhiều trong môi trường pH 4,5.
- Còn khi khảo sát khả năng mang thuốc 5-FU của hạt sau biến tính bằng phương pháp đo HPLC cho thấy hiệu suất mang thuốc trung bình là cao nhất chỉ có hệ PNS-GPTMS- CS-mPEG là 70,04% nhưng không giải phóng được trong cả 2 môi trường 7,4 và 4,5.
- Với hệ nano silicate biến tính Hydrazine, Chitosan-mPEG, Hydrazine, Gelatin-mPEG thích hợp mang thuốc DOX hơn mang thuốc 5FU.
- Đã đo được độc tính tế bào của hệ PNS-APTES-COOH-GE cho kết quả phù hợp.
Tính mới chúng tôi đạt được ở đây là:
- Khảo sát được các yếu tố ảnh hưởng đến kích thước của vật liệu nano silicas xốp dựa trên kết quả của những nghiên cứu đối lập giữa các nhóm nhà khoa học trước kia (Stober và cộng sự, Bogush và công sự, Helden và cộng sự) [62-64].
- Tìm ra phương pháp mang thuốc hiệu quả cao đối với DOX, đó là biến vật liệu có chứa nhóm amino tạo liên kết imine giữa thuốc DOX và chất mang nhờ đó mà hiệu suất mang thuốc cao hơn so với những nghiên cứu trước đây [35, 101]. Bên cạnh đó, nhờ liên kết imine mà tất cả nhưng hệ biến tính mang thuốc DOX đều cho kết quả giải phóng thuốc hướng đích rất tốt. Cụ thể là liên kết imine sẽ bền trong môi trường trung tính của tế bào cơ thể khỏe mạnh pH ~7,4 và giúp thuốc lưu thông trong máu
lâu dài. Khi đến gần tế bào ung thư (pH khoảng 4,5) thì liên kết imine trở nên kém bền sẽ bị phá vỡ, lúc này giải phóng đúng mục tiêu là tế bào ung thư. Tất cả những hệ biến tính đã thực hiện là hệ mang thuốc DOX nhạy pH khá tốt.
4.2. Kiến nghị
- Tiếp tục nghiên cứu tổng hợp vật liệu nano silica từ nguồn nguyên liệu sinh khối.
- Tiếp tục biến tính trên vật liệu nano silica được sản xuất từ nguồn nguyên liệu sinh khối với tiêu chí an toàn dược liệu và thân thiện với môi trường.
- Thử độc tính tế bào vật liệu nano silica sản xuất từ nguồn nguyên liệu sinh khối.
- Hệ biến PNS-APTES-COOH-GE mang DOX vẫn chưa gây độc đối với tế bào ung thư cổ tử cung (Hela), nên cần thay đổi tỷ lệ thuốc và chất mang hoặc tăng lượng gelatin khi biến tính.
TÀI LIỆU THAM KHẢO
1. Xie, M., et al., A multifunctional mesoporous silica nanocomposite for targeted delivery, controlled release of doxorubicin and bioimaging. Colloids and Surfaces B: Biointerfaces, 2013. 110: p. 138-147.
2. Zhang, Y., H.F. Chan, and K.W. Leong, Advanced materials and processing for drug delivery: the past and the future. Advanced drug delivery reviews, 2013. 65(1): p. 104-120.
3. Manzano, M. and M. Vallet‐Regí, Mesoporous silica nanoparticles for drug delivery.
Advanced functional materials, 2020. 30(2): p. 1902634.
4. Fernández, L.D., E. Lara, and E.A. Mitchell, Checklist, diversity and distribution of testate amoebae in Chile. European Journal of Protistology, 2015. 51(5): p. 409-424.
5. Iler, K.R., The chemistry of silica. Solubility, polymerization, colloid and surface properties and biochemistry of silica, 1979.
6. Shelke, G., G. Deshmukh, and D. Patil, Structural Analysis”. International Journal of Current Research.
7. Tourne-Peteilh, C., et al., Sol–gel one-pot synthesis in soft conditions of mesoporous silica materials ready for drug delivery system. Journal of sol-gel science and technology, 2012. 61(3): p. 455-462.
8. Katiyar, A., et al., Synthesis of ordered large pore SBA-15 spherical particles for adsorption of biomolecules. Journal of Chromatography A, 2006. 1122(1-2): p. 13- 20.
9. Trewyn, B.G., et al., Biocompatible mesoporous silica nanoparticles with different morphologies for animal cell membrane penetration. Chemical Engineering Journal, 2008. 137(1): p. 23-29.
10. Angelos, S., et al., Mesoporous silicate materials as substrates for molecular machines and drug delivery. Chemical Engineering Journal, 2008. 137(1): p. 4-13.
11. Singh, R. and J.W. Lillard Jr, Nanoparticle-based targeted drug delivery.
Experimental and molecular pathology, 2009. 86(3): p. 215-223.
12. Ibrahim, I.A., A. Zikry, and M.A. Sharaf, Preparation of spherical silica nanoparticles: Stober silica. J. Am. Sci, 2010. 6(11): p. 985-989.
13. Svenson, S. and D.A. Tomalia, Dendrimers in biomedical applications—reflections on the field. Advanced drug delivery reviews, 2012. 64: p. 102-115.
14. Malik, N., E.G. Evagorou, and R. Duncan, Dendrimer-platinate: a novel approach to cancer chemotherapy. Anti-cancer drugs, 1999. 10(8): p. 767-776.
15. Lim, M.H. and A. Stein, Comparative studies of grafting and direct syntheses of inorganic− organic hybrid mesoporous materials. Chemistry of Materials, 1999. 11(11): p. 3285-3295.
16. Slowing, I., B.G. Trewyn, and V.S.-Y. Lin, Effect of surface functionalization of MCM-41-type mesoporous silica nanoparticles on the endocytosis by human cancer cells. Journal of the American Chemical Society, 2006. 128(46): p. 14792-14793.
17. Hench, L.L. and J.K. West, The sol-gel process. Chemical reviews, 1990. 90(1): p. 33-72.
18. RS Dubey, Y.R., MA More Synthesis and characterization of SiO2 nanoparticles via sol-gel method for industrial applications. Materials Today: Proceedings.





