DANH MỤC CÁC BẢNG
Bảng 1.1. Các gen và protein của RV 9
Bảng 3.1. Tóm tắt các đặc điểm nhân khẩu học ở những người tình nguyện 64 Bảng 3.2. Kết quả xét nghiệm máu ở người tình nguyện trước khi uống, so
sánh với chỉ số bình thường 65
Bảng 3.3. Tỷ lệ người tình nguyện có biểu hiện sốt (trên 38oC) trong vòng 30 ngày sau mỗi liều 67
Bảng 3.4. Tỷ lệ có những triệu chứng đáng chú ý trong vòng 30 ngày sau mỗi liều vắc xin 68
Bảng 3.5. So sánh các kết quả xét nghiệm huyết học và sinh hóa lần 1 và lần 2 69 Bảng 3.6. So sánh các kết quả xét nghiệm huyết học và sinh hóa lần 1 và lần 3 70 Bảng 3.7. Tuổi của trẻ tham gia nghiên cứu sau các liều vắc xin ở các
nhóm uống vắc xin khác nhau 71
Bảng 3.8. Kết quả xét nghiệm máu ở trẻ ở các nhóm trước khi uống 72
Có thể bạn quan tâm!
-
 Đánh giá tính an toàn và tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam sản xuất - 1
Đánh giá tính an toàn và tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam sản xuất - 1 -
 Sơ Đồ Cấu Trúc Hạt Virut Rota Và Các Vùng Mã Hóa Protein
Sơ Đồ Cấu Trúc Hạt Virut Rota Và Các Vùng Mã Hóa Protein -
 Tình Hình Nghiên Cứu Sản Xuất Vắc Xin Rota Trên Thế Giới
Tình Hình Nghiên Cứu Sản Xuất Vắc Xin Rota Trên Thế Giới -
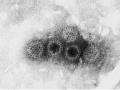
![Hình Ảnh Hạt Virut Rota G1P [8] Dưới Kính Hiển Vi Điện Tử Tại Lần Cấy Truyền Thứ 30 Trên Tế Bào Thận Khỉ Tiên Phát Chụp Dưới Kính Hiển Vi](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Hình Ảnh Hạt Virut Rota G1P [8] Dưới Kính Hiển Vi Điện Tử Tại Lần Cấy Truyền Thứ 30 Trên Tế Bào Thận Khỉ Tiên Phát Chụp Dưới Kính Hiển Vi
Hình Ảnh Hạt Virut Rota G1P [8] Dưới Kính Hiển Vi Điện Tử Tại Lần Cấy Truyền Thứ 30 Trên Tế Bào Thận Khỉ Tiên Phát Chụp Dưới Kính Hiển Vi
Xem toàn bộ 163 trang tài liệu này.
Bảng 3.9. Trường hợp tiêu chảy có RV trong phân sau khi uống vắc xin liều 1
ở các nhóm nghiên cứu 84

Bảng 3.10. Trường hợp tiêu chảy có RV trong phân sau khi uống vắc xin liều 2
ở các nhóm theo liều uống 84
Bảng 3.11. Trường hợp tiêu chảy có RV trong phân sau khi uống vắc xin liều
3 ở các nhóm theo liều uống 85
Bảng 3.12. Tổng hợp trẻ tham gia nghiên cứu trong giai đoạn III 86
Bảng 3.13. Tuổi (ngày) của trẻ tham gia nghiên cứu tại các thời điểm tham
gia nghiên cứu 87
Bảng 3.14. Cân nặng (kg) của trẻ tại các thời điểm tham gia nghiên cứu 88
Bảng 3.15. Chiều cao (cm) của trẻ tham gia nghiên cứu tại các thời điểm
tham gia nghiên cứu 88
Bảng 3.16. Các triệu chứng không mong muốn ở trẻ uống vắc xin/giả dược 7
ngày sau mỗi liều tại cả 2 địa điểm nghiên cứu 89
Bảng 3.17. Các triệu chứng không mong muốn ở trẻ tham gia nghiên cứu tại
cả 2 địa điểm nghiên cứu 8-30 ngày sau khi uống liều 1 và 2 91
Bảng 3.18. Mẫu phân tiêu chảy thu thập được trong thời gian nghiên cứu và khả năng phân lập RV trong phân 94
Bảng 3.19. Một số đặc điểm lâm sàng trẻ tiêu chảy trong phân có virut Rota . 95 Bảng 3.20. Hiệu giá kháng thể IgA kháng virut Rota trong huyết thanh của
các đối tượng uống vắc xin nghiên cứu và vắc xin Rotarix 96
Bảng 3.21. Hiệu giá kháng thể RV-IgA ở nhóm R (Rotavin) và nhóm E (Rotarix) tại các thời điểm (trước khi tham gia nghiên cứu Mo, 3 và 12 tháng sau liều 1 vắc xin (M2 và M3) 101
Bảng 3.22. Tỷ lệ đối tượng có kháng thể IgA kháng virut Rota dương tính
thời điểm 1 năm sau liều 1 102
Bảng 3.23. Tỷ lệ trẻ có kháng thể RV-IgA trước khi uống vắc xin/giả dược...103 Bảng 3.24. So sánh các mức hiệu giá kháng thể IgG ở trẻ trước khi uống vắc xin/giả dược tại 2 địa điểm nghiên cứu 104
Bảng 3.25. Tỷ lệ chuyển đổi kháng thể IgA tại thời điểm 1 tháng sau uống liều 2 106
Bảng 3.26. Hiệu giá trung bình nhân của kháng thể IgA trước và sau khi uống vắc xin/giả dược tại các địa điểm nghiên cứu 107
Bảng 3.27. Hiệu giá trung bình nhân của kháng thể IgG tại các thời điểm thăm khám 108
Hình 1.1. Sự phân bố các chủng RV trên toàn cầu 5
Hình 1.2. Ảnh chụp RV dưới kính hiển vi điện tử 5
Hình 1.3. Sơ đồ cấu trúc hạt virut Rota và các vùng mã hóa protein 6
Hình 1.4. Hình ảnh hạt virut Rota G1P dưới kính hiển vi điện tử tại lần cấy truyền thứ 30 trên tế bào thận khỉ tiên phát chụp dưới kính hiển vi điện tử - Viện VSDTTƯ 22
Hình 1.5. Tóm tắt qui trình phát triển một loại thuốc mới 26
Hình 1.6. Tóm tắt các giai đoạn thử nghiệm vắc xin 33
Hình 2.1. Sơ đồ tuyển chon và phân nhóm đối tượng giai đoạn 1 50
Hình 2.2. Sơ đồ uống vắc xin và lấy mẫu theo dõi an toàn giai đoạn 1 51
Hình 2.3. Sơ đồ tuyển chọn và phân nhóm đối tượng giai đoạn 2 54
Hình 2.4. Sơ đồ uống vắc xin và lấy mẫu xét nghiệm giai đoạn 2 nhóm C, E và N .. 55 Hình 2.5. Sơ đồ uống vắc xin và lấy mẫu xét nghiệm giai đoạn 2 nhóm B và R .55 Hình 2.6. Tóm tắt tuyển chọn và thực hiện cho uống vắc xin tại Thành phố
Thái Bình 60
Hình 2.7. Tóm tắt tuyển chọn và thực hiện cho uống vắc xin tại Thanh Sơn - Phú Thọ 61
Hình 2.8. Tóm tắt tuyển chọn và thực hiện cho uống vắc xin cả hai địa điểm 62
Hình 2.9. Sơ đồ uống vắc xin và lấy mẫu xét nghiệm giai đoạn 3 63
Đồ thị 1. Chủng lưu hành gây bệnh theo týp G từ 1998 – 2009 16
Đồ thị 2. Chủng lưu hành gây bệnh theo týp P từ 2000 - 2011 17
Biểu đồ 3.1. So sánh chỉ số men gan trung bình trước khi uống và sau mỗi liều vắc xin. Đường kẻ ngang thể hiện chỉ số bình thường 70
Biểu đồ 3.2. Chỉ số hồng cầu ở trẻ trước và sau khi uống vắc xin ở các
nhóm khác nhau 73
Biểu đồ 3.3. Chỉ số bạch cầu ở trẻ trước và sau khi uống vắc xin 73
Biểu đồ 3.4. Chỉ số tiểu cầu ở trẻ trước và sau khi uống vắc xin 73
Biểu đồ 3.5. Nồng độ SGOT trước và sau khi uống vắc xin 74
Biểu đồ 3.6. Nồng độ SGPT ở trẻ trước và sau khi uống vắc xin 74
Biểu đồ 3.7. Nồng độ urê trong huyết thanh trẻ trước và sau khi uống vắc xin 74
Biểu đồ 3.8. Tỷ lệ trẻ có các biểu hiện không mong muốn trong vòng 7 ngày sau liều 1 ở các nhóm nghiên cứu 76
Biểu đồ 3.9. So sánh tỷ lệ trẻ ở các nhóm có phản ứng không mong muốn từ ngày thứ 8 đến ngày 30 sau liều 1 77
Biểu đồ 3.10. Tỷ lệ trẻ có triệu chứng không mong muốn trong vòng 1 - 7 ngày sau khi uống liều 2 79
Biểu đồ 3.11. Tỷ lệ trẻ có triệu chứng không mong muốn từ ngày 8-30 sau khi uống liều 2 80
Biểu đồ 3.12. Tỷ lệ trẻ có các triệu chứng không mong muốn trong vòng 7 ngày sau liều 3 81
Biểu đồ 3.13. Tỷ lệ trẻ có triệu chứng không mong muốn trong vòng 8-30 ngày sau liều 3 82
Biểu đồ 3.14. Các triệu chứng không mong muốn trong 7 ngày uống liều 1 và 2 ở trẻ tham gia nghiên cứu tại Thành phố Thái Bình và huyện Thanh Sơn, tỉnh Phú Thọ 90
Biểu đồ 3.15. Các dấu hiệu/ triệu chứng từ ngày 8 – 30 sau uống liều 1 và 2 tại Thành phố Thái Bình và huyện Thanh sơn, Phú Thọ 92
Biểu đồ 3.16. Các triệu chứng không mong muốn ở cả 2 địa điểm nghiên cứu trong vòng 30 ngày sau mỗi liều vắc xin/giả dược 93
Biểu đồ 3.17. Tỷ lệ trẻ có động lực IgA 1 tháng sau liều vắc xin cuối cùng ở
các nhóm nghiên cứu 97
Biểu đồ 3.18. Đáp ứng kháng thể RV- IgA sau 2 liều và 3 liều vắc xin ở
nhóm C và N 98
Biểu đồ 3.19. Tỷ lệ trẻ có chuyển đổi kháng thể RV-IgG trong huyết thanh ở
các nhóm nghiên cứu 99
Biểu đồ 3.20. Hiệu giá kháng thể RV-IgG trước và sau khi uống vắc xin ở
các nhóm nghiên cứu 99
Biểu đồ 3.21. Hiệu giá RV-IgA ở 2 nhóm nghiên cứu tại các thời điểm ... 101 Biểu đồ 3.22. Sự phân bố các mức hiệu giá kháng thể IgG ở trẻ trước khi
uống vắc xin tại 2 địa điểm nghiên cứu 105
Biểu đồ 3.23. Tỷ lệ chuyển đổi kháng thể IgA tại thời điểm 1 tháng sau uống liều 2 106
Biểu đồ 3.24. Hiệu giá trung bình nhân của kháng thể IgA trước và sau khi uống vắc xin/giả dược tại các địa điểm nghiên cứu 107
Biểu đồ 3.25. Tỷ lệ giữa hiệu giá kháng thể IgG trong mẫu M2 và mẫu Mo ở
trẻ tham gia nghiên cứu 109
Biểu đồ 3.26. Hiệu giá trung bình nhân của kháng thể IgG tại các thời điểm thăm khám 110
Biểu đồ 3.27. Tổng hợp phân bố hiệu giá IgA sau liều 2 tại Thành phố Thái Bình 111
Biểu đồ 3.28. Tổng hợp phân bố hiệu giá IgA sau liều 2 tại Thanh Sơn – Phú Thọ 112
Biểu đồ 3.29. Tổng hợp phân bố hiệu giá IgA sau liều 2 tại 2 địa điểm
nghiên cứu 112
ĐẶT VẤN ĐỀ
Bệnh tiêu chảy do virut Rota là căn bệnh viêm dạ dày ruột cấp tính phổ biến ở trẻ em trên toàn thế giới. Ở các nước phát triển có 35 - 52% trẻ em bị tiêu chảy cấp là do virut Rota. Ở các nước đang phát triển, tỷ lệ tử vong ở trẻ em do tiêu chảy chiếm 1/3 tổng số tử vong vì mọi nguyên nhân, trong đó tỷ lệ tử vong do tiêu chảy liên quan đến virut Rota chiếm khoảng 20 – 40%. Hàng năm, trên thế giới có khoảng trên 600 nghìn trẻ chết vì tiêu chảy do virut Rota, chiếm 5% số ca chết vì mọi nguyên nhân ở trẻ em dưới 5 tuổi [6],[13],[49],[116].
Tại Việt Nam, hàng năm tỷ lệ mắc tiêu chảy do virut Rota chiếm trên 50% trong tổng số trẻ em dưới 5 tuổi bị tiêu chảy vào điều trị tại một số Bệnh viện Nhi lớn của Việt Nam [6], [99], [114].
Như vậy, tiêu chảy do virut Rota ở trẻ em là một gánh nặng đối với tất cả các nước trên thế giới. Việc cải thiện điều kiện vệ sinh cũng không làm giảm tỷ lệ mắc tiêu chảy do virut Rota, do vậy biện pháp phòng bệnh hiệu quả nhất hiện nay là sử dụng vắc xin. Hiện nay, nhiều nước trên thế giới đã và đang đặc biệt quan tâm đến vấn đề sản xuất vắc xin phòng bệnh do virut Rota [11], [14], [46].
Tại Việt Nam, từ năm 2008, vắc xin Rotarix của Hãng Glaxo Smith Kline đã được đưa vào sử dụng trên thị trường. Tuy nhiên, giá thành của vắc xin này rất cao >700.000 đồng/liều. Do vậy không nhiều người dân có đủ điều kiện để sử dụng vắc xin này cho con em họ.
Từ thực tế đó, POLYVAC được Bộ Y tế giao nhiệm vụ nghiên cứu sản xuất vắc xin Rota nhằm chủ động nguồn vắc xin cho nhu cầu trong nước thông qua đề tài nghiên cứu qui trình công nghệ sản xuất vắc xin Rota tại Việt Nam. Đề tài đã được nghiệm thu đạt kết quả xuất sắc. Để triển khai bước tiếp
theo nhằm tiến tới xin cấp đăng ký sử dụng vắc xin Rota tại Việt Nam, chúng tôi đã sử dụng sản phẩm của đề tài cấp nhà nước nói trên là các loạt vắc xin Rotavin-M1 đã được đánh giá trong phòng thí nghiệm và tiền lâm sàng và được Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm Y tế cấp giấy chứng nhận chất lượng để tiến hành đề tài: “Đánh giá tính an toàn và tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam sản xuất”.
Mục tiêu của luận án:
1. Đánh giá tính an toàn của vắc xin Rotavin-M1 do Việt Nam sản xuất.
2. Đánh giá tính sinh miễn dịch của vắc xin Rotavin-M1 do Việt Nam
sản xuất.
3. Xác định liều dùng và lịch sử dụng thích hợp.
CHƯƠNG 1
TỔNG QUAN
1.1. Virut Rota
Virut Rota (RV) là virut không màng, có vật liệu di truyền ARN kép, thuộc họ Reoviridae [17],[18],[78]. Họ này gồm có các nhóm: Reovirut, Coltivirut, Cypovirut, Fijivirut, Orbivirut, Phytoreovirut, Oryzavirut, Reovirut. RV gây bệnh ở động vật có vú, chim, bò sát. Virut có hình khối tròn, đường kính trung bình từ 65-70 nm, giống như một cái bánh xe có các gai ngắn và một cái vành rất nhẵn do vậy có tên là RV [48].
RV được chia thành 7 nhóm; A, B, C, D, E, F và G, trong đó chỉ có nhóm A, B, C gây bệnh cho cả người và động vật [83]. Nhóm D, E, F, G chỉ thấy ở động vật. Nhóm A hay gặp nhất, gây ra hầu hết các vụ dịch tiêu chảy nặng ở trẻ em. Nhóm B thường gây ra những vụ dịch tiêu chảy nặng trên người lớn ở Trung Quốc, còn nhóm C gây ra các trường hợp lẻ tẻ trong các vụ dịch tiêu chảy ở trẻ. VP6 là kháng nguyên quyết định nhóm và phân nhóm, I hoặc II [28],[29],[30].
Các týp huyết thanh và genotype.
Týp huyết thanh của RV được đặc trưng bởi hai protein capsid lớp ngoài là VP4 và VP7, xác định bởi kỹ thuật trung hoà, sử dụng kháng huyết thanh tạo ra ở động vật [124]. Giống như virut cúm, phân loại RV dựa trên cùng một lúc VP4 (týp huyết thanh P) và VP7 (týp huyết thanh G). Ví dụ chủng Wa (G1P1A) phân lập từ người thuộc nhóm A, phân nhóm II, týp huyết thanh G1 và P1A, còn chủng DS-1 (G2P1B) thuộc nhóm A, phân nhóm I, týp huyết thanh G2 và P1B. Gần đây RV còn được phân loại dựa theo genotype. Đối VP7, týp huyết thanh G (phân loại bằng kỹ thuật trung hoà) và genotype G (xác định bằng RT-PCR) có mối liên quan chặt chẽ với



![Hình Ảnh Hạt Virut Rota G1P [8] Dưới Kính Hiển Vi Điện Tử Tại Lần Cấy Truyền Thứ 30 Trên Tế Bào Thận Khỉ Tiên Phát Chụp Dưới Kính Hiển Vi](https://tailieuthamkhao.com/uploads/2022/11/11/danh-gia-tinh-an-toan-va-tinh-sinh-mien-dich-cua-vac-xin-rotavin-m1-do-viet-nam-5-1-120x90.jpg)