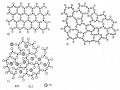
loại: compozit hạt thô và compozit hạt mịn.
Compozit hạt thô rất đa dạng và được sử dụng phổ biến trong các lĩnh vực công nghiệp.
Compozit hạt mịn thường là các vật liệu bền nóng và ổn định nóng. Do vậy nó được dùng để thay thế các vật liệu truyền thống nhằm nâng cao hiệu suất hoặc kéo dài tuổi thọ thiết bị, công trình trong các điều kiện sử dụng tương đương.
Compozit hạt thô nền polyme: hạt cốt là thạch anh, thủy tinh, oxyt nhôm... Được sử dụng phổ biến trong đời sống như cửa, tường ngăn, trần nhà...
Composit hạt thô nền kim loại, hạt cốt là các phần tử cứng như WC, TiC, TaC nền là Co dùng làm dụng cụ cắt gọt, khuôn kéo, khuôn dập... Ngoài ra còn có các hợp kim giả: W-Cu, W-Ag, Mo-Cu, Mo-Ag... sử dụng trong kỹ thuật điện.
Compozit hạt thô nền gốm điển hình là bê tông. Cốt là tập hợp các hạt rắn như đá, sỏi... liên kết bởi nền là xi măng. Bê tông atphan (nền là xi măng atphan) dùng rải đường, làm cầu, cống... Bê tông với nền là xi măng pooc lăng sử dụng rộng rãi trong xây dựng nhà cửa, các công trình...
Compozit hạt mịn, các phân tử cốt có kích thước rất nhỏ, cứng và ổn định nhiệt cao, phân bố trên nền kim loại hay hợp kim, được sử dụng trong lĩnh vực nhiệt độ cao.
6.3. Compozit cốt sợi

Đây là loại vật liệu kết cấu quan trọng nhất, hiện đang nghiên cứu và sử dụng phổ biến. Cấu tạo của nó gồm cốt dạng sợi phân bố trong nền theo quy luật đã thiết kế.

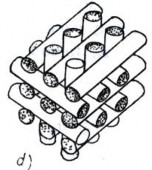
a) b)

c)
a. một chiều song song
Hình 6.2. Sơ đồ phân bố cốt sợi
b. ngẫu nhiên, rối trong một mặt
c. dệt hai chiều vuông góc trong một mặt
d. đan, quấn ba chiều vuông góc
Mục tiêu chủ yếu nhất khi thiết kế chế tạo compozit cốt sợi là độ bền riêng và mô đun đàn hồi riêng cao. Do vậy, cả nền và sợi đều cần có khối lượng riêng nhỏ, nền phải tương đối dẻo, còn sợi cốt phải có độ cứng vững và bền cao. Tính chất của compozit cốt sợi phụ thộc vào nhiều yếu tố như bản chất vật liệu cốt và nền, độ bền liên kết nền và cốt trên ranh giới, sự phân bố và định hướng sợi, kích thước, hình dạng của nó...
Đối với một compozit cốt sợi xác định mà ta khảo sát, nếu coi liên kết cốt-nền là hoàn hảo, thì cơ tính của vật liệu đó chịu ảnh hưởng trực tiếp của các yếu tố như sự phân bố, kích thước, hình dạng và hàm lượng của cốt sợi.
Compozit sợi thủy tinh, hiện tại là vật liệu thông dụng nhất, cốt là sợi thủy tinh nền là polyeste đôi khi dùng bakelit. Công dụng làm mui xe hơi, thùng xe lạnh, sitec, mũi máy bay, vỏ bảo vệ buồng lái tàu vũ trụ.
Compozit sợi cacbon, cốt là sợi cacbon, hay sợi thủy tinh. Nền là epoxi- phenon, polyeste hay cacbon. Công dụng dùng làm thân máy bay quân sự, phần lái cánh tàu bay, thùng xe hơi, công nghiệp tàu thủy, vật liệu cách nhiệt của động cơ, đĩa ma sát...
Composit sợi hữu cơ, cốt là các sợi polyme. Công dụng làm vật liệu cách nhiệt,
cách điện, các kết cấu ô tô, máy bay...
6.4. Compozit cấu trúc
Compozit cấu trúc là để chỉ các bán thành phẩm dạng lớp, dạng tấm ba lớp được tạo thành bằng cách kết hợp với vật liệu đồng nhất với vật liệu compozit theo những phương án cấu trúc khác nhau. Vì vậy, tính chất của nó phụ thuộc không chỉ vào tính chất các vật liệu thành phần mà còn vào sự sắp xếp và kiến trúc hình học của chúng trong kết cấu nữa. Các compozit cấu trúc dạng lớp và dạng tấm ba lớp được sử dụng trong nhiều lĩnh vực: vận tải, hàng không, các công trình xây dựng kiến trúc... Nhiều loại compozit cấu trúc khác loại vật liệu chức năng (siêu dẫn, vật liệu từ) chỉ được ứng dụng trong nhữ lĩnh vực nhất định.
a. Compozit cấu trúc dạng lớp
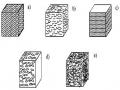
Compozit loại này được tạo thành từ các lớp cơ sở. Các lớp cơ sở này thường gồm hai loại, loại thứ nhất là các lớp đóng vai trò liên kết, thường là vật liệu đồng nhất và loại thứ hai là các lớp chịu lực, thường là các băng compozit cốt sợi. Sắp xếp lần lượt các lớp này và đổi hướng các băng compozit sao cho thỏa mãn yêu cầu thiết kế đề ra rồi ép dính lại. Kết quả nhận được ở dạng bán thành phẩm, tấm, thanh, ống... Đó chính là compozit cấu trúc dạng lớp.
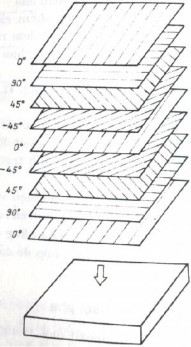
Hình 6.3. Sơ đồ sắp xếp các lớp cơ sở khi tạo ra compozit cấu trúc dạng lớp
Compozit cấu trúc dạng lớp cũng có thể tạo thành từ các lớp cơ sở có định hướng nhiều phương. Chẳng hạn, các tấm vải bông, vải sợi thủy tinh hoặc cacbon được ép lại nhờ chất kết dính là polyme, sẽ cho ta các compozit cấu trúc dạng lớp có độ bền cao theo phương bất kỳ song song với mặt tấm.
Nhược điểm chung của loại compozit này là độ bền theo phương vuông góc với lớp cơ sở thấp.
Compozit này được sử dụng trong hàng không, xây dựng các công trình, chế tạo dụng cụ máy móc và các loại dụng cụ văn hóa thể thao.
b. Compozit cấu trúc dạng tấm ba lớp
Loại này còn có tên gọi là panel sandwich. Khác loại trên, panel sandwich chỉ gồm ba lớp. Hai lớp mặt được chế tạo từ vật liệu có độ bền và cứng vững cao như hợp kim nhôm, hợp kim titan, thép và các tấm compozit cấu trúc dạng lớp... Chức năng chủ yếu của chúng là chịu toàn bộ tải trọng (kéo, nén và uốn) tác dụng theo các chiều song song với mặt tấm.
Lớp lòi nằm giữa hai lớp mặt là vật liệu nhẹ, độ bền và cứng vững tương đối nhỏ. Lớp này có tác dụng duy trì khoảng cách giữa hai lớp mặt và giảm biến dang theo chiều vuông góc với mặt tấm, tạo độ cứng vững nhất định, tránh các hiện tượng cong vênh tấm.
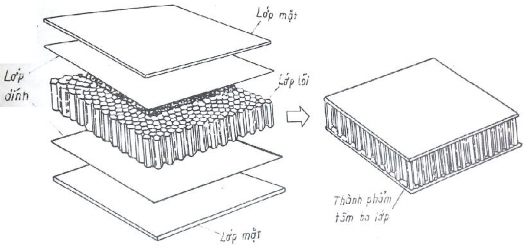
Hình 6.4. Sơ đồ cấu tạo compozit cấu trúc dạng tấm ba lớp
Trong kỹ thuật thường gặp hai loại lòi:
Loại thứ nhất có tổ chức xốp bọt như cao su nhân tạo, polyme bọt, chất dính kết
vô cơ hoặc gỗ nhẹ...
Loại thứ hai cấu tạo theo dạng tổ ong, trong đó các vách hướng vuông góc với mặt tấm.
ngăn liên kết định
Vách ngăn thường rất mỏng và được chế tạo từ cùng vật liệu như hai lớp mặt. Compozit cấu trúc dạng tấm ba lớp được ứng dụng rất rộng rãi. Ví dụ làm trần,
sàn, tường trong xây dựng nhà cửa, làm vỏ, thân, cánh và đuôi các loại máy bay.[2]
Câu hỏi ôn tập
Câu 1. Thế nào là vật liệu compozit, đặc điểm của loại vật liệu này. Câu 2. Trình bày cách phân loại vật liệu compozit.
Câu 3. Trình bày vật liệu compozit cốt sợi. Câu 4. Trình bày vật liệu compozit cốt hạt. Câu 5. Trình bày vật liệu compozit cấu trúc.
CHƯƠNG 7
ĂN MÒN VÀ BẢO VỆ VẬT LIỆU
7.1. Khái niệm chung về ăn mòn kim loại
Ăn mòn là sự phá hoại các tính chất lý học, hóa học, cơ học và hình dáng của chi tiết, chủ yếu là thay đổi trạng thái oxy hóa của kim loại, oxyt, bán dẫn.
Ăn mòn được chia ra làm hai loại: ăn mòn điện hóa và ăn mòn hóa học.
Ăn mòn hóa học là sự phá hủy kim loại do kim loại phản ứng hóa học với các chất khí hoặc hơi nước. Bản chất của ăn mòn hóa học là quá trình oxy hóa- khử trong đó các electron của kim loại được chuyển trực tiếp sang môi trường tác dụng.
Ăn mòn điện hóa là sự phá hủy kim loại do kim loại tiếp xúc trực tiếp với dung dịch chất điện ly và tạo nên dòng điện ăn mòn
7.2. Cơ chế ăn mòn điện hoá
Khi có một kim loại M tiếp xúc với dung dịch điện ly, sẽ có hai quá trình xảy ra: Phản ứng anôt (oxy hóa): M → Mn+ +ne
Phản ứng catôt (hoàn nguyên hoặc khử): Xn- +ne → X
7.2.1. Các phản ứng điện hóa
a. Không có oxy
). Ví dụ
→
2 +
sắt tro
+
2 →
g môi
Trong môi trường axit (pH<7 n trường axit không có oxy hòa
2
2
+
+
→
tan.
b. Có ox
+
→
y
Trong
+
ôi tr
m
2
→
rường
ường
kiề
ax
m ((p
it (pH<7). Ví dụ: sắt trong nước chứa axit có oxy hòa tan. (phản ứng anôt)
+
+
4 4 2 (phản ứng anôt)
M
+
như nướ
+ 2
ôi t
c biển.
→
H
>7). Ví dụ sắt trong môi trường trung tính, thoáng khi
+
2
(phả (phản
+
dàng lắng
ứng anôt
ứng anôt
→
động,
)
)
(
không b
n
+
Sản p
+
cuối
→
cùng
4 4 4
ẩm
à :
)
ền,
h l 2 4
dễ
(
dễ dàng
dễ b
(
o thành
i ox
)
lớp
Hydroxyt sắt hai y hóa mạnh thành
hydroxyt sắt ba.
) +
mất
+
t ít nư
→
c để
2 1/2 2
mộ
Hydroxyt sắt ba ớ tạ oxyt xốp không ổn định có công thức: xFeO. yFe2O3. H2O.
Sắt rất dễ bị ăn mòn vì Fe là đi ện cực kép, tại đó có cả hai phản ứng caôt và
anôt.
7.2.2. Xu thế ăn mòn
a. Điện thế điện cực
Khi nhúng kim loại M trong dung dịch điện ly chứa ion Mn+, luôn luôn có phản
ứng cân bằng giữa kim loại và dung dịch, không xảy ra hiện tượng ăn mòn.
Oxy hóa ![]()
M Mn+ +ne
Hoàn nguyên
Như vậy kim loại là điện cực thuận nghịch. Trong dung dịch, trên bề mặt kim loại có lớp ion kép, tại vùng này nồng độ ion dày đặc và cao hơn chỗ khác trong dung dịch điện ly.
ện thế
=
cân b
+
ằng diễn
ta
số chất khí,
the
Ở điện cực thuận nghị có đi o biểu thức Nernst
Trong đó E0 là điện thế chuẩn; R hằng F là hằng số Faraday
Cần xét và so sánh điện thế cân bằng của các kim loại mới biết được tính ổn định nhiệt động của các kim loại và đánh giá được xu thế ăn mòn của chúng.
Bảng 7.1. Thế điện cực của các kim loại
Điện thế tiêu chuẩn cân bằng so với điện cực hyđrô E0, V | |
Au3+ + 3e ↔ Au | 1.50 |
O2 + 4H+ + 4e ↔ 2H2O | 1.23 |
Ag+ + e ↔ Ag | 0.80 |
O2 + 2H2O + 4e ↔ 4OH- | 0.40 |
2H+ + 2e ↔ H2 | 0.00 |
Pb2+ + 2e ↔ Pb | - 0.13 |
Sn2+ + 2e ↔ Sn | - 0.40 |
Fe2+ + 2e ↔ Fe | -0.44 |
Cr3+ + 3e ↔ Cr | -0.74 |
Zn2+ + 2e ↔ Zn | -0.76 |
Al3+ + 3e ↔ Al | -1.67 |
Mg2+ + 2e ↔ Mg | -2.37 |
Na+ + e ↔ Na | -2.71 |
Có thể bạn quan tâm!
-
 Sơ Đồ Mô Tả Quá Trình Hydrat Hóa Và Đông Đặc Của Vữa Xi Măng
Sơ Đồ Mô Tả Quá Trình Hydrat Hóa Và Đông Đặc Của Vữa Xi Măng -
 Tính Chất Gia Công Của Vật Liệu Polyme
Tính Chất Gia Công Của Vật Liệu Polyme -
 Sơ Đồ Minh Họa Cấu Tạo Compozit
Sơ Đồ Minh Họa Cấu Tạo Compozit -
 Vật liệu kỹ thuật 2 - 22
Vật liệu kỹ thuật 2 - 22 -
 Vật liệu kỹ thuật 2 - 23
Vật liệu kỹ thuật 2 - 23
Xem toàn bộ 193 trang tài liệu này.
![]()
Thông thường để đo thế điện cực của kim loại phải dùng cách đo so sánh, quy ước điện thế của phản ứng 2H++2e- H2 bằng 0 để làm chuẩn. Cho nên nếu nói rằng
u là 0,78V
= 0
![]()
điện thế so sánh giữa Fe và C
thì
=
có ngh
/
ĩa l
−
à:
/
cân bằng oxy hóa- khử
,78
Bảng số liệu điện thế chuẩn của
ở 250C nêu trên chỉ cho
biết xu thế ăn mòn còn trong thực tế để xảy ra ăn mòn còn phải có dòng điện chạy từ phía ngoài và dòng ion chạy trong chất điện ly giữa hai cực.
Tất cả các kim loại có điện thế thấp hơn điện thế của hydro sẽ bị ăn mòn trong axit (không có oxy) để giải phóng khí H2 bay ra. Đặc biệt, Cu có thế điện cực cao hơn thế điện cực của H nên không bị ăn mòn, nhưng nếu trong môi trường axit có oxy thì Cu cũng sẽ bị ăn mòn.
ọn
b. Đánh giá ăn mòn
o
Đánh giá the
trong 1 ngày.
G (mg/dm2. ngày)=
số gam kim loại bị ăn mòn trên 1 đơn v ị diện tích
tr g lượng:
Chiều dày bị ăn mòn xâm nhập: chiều dày kim loại bị ăn mòn tính theo năm.
S<0,125mm/năm : kim loại rất bền
S<1,125 – 1,25mm/năm : kim loại đạt yêu cầu chống ăn mòn S> 1,25mm/năm: không đạt yêu cầu
7.2.3. Các dạng ăn mòn đi ện hóa
Ăn mòn điện hóa là dạng ăn mòn phổ biến hơn cả và phá hủy kim loại nhiều nhất. Các dạng ăn mòn đi ện hóa được chia ra làm các loại sau: ăn mòn đều, ăn mòn tiếp xúc, ăn mòn do chênh lệch khí, ăn mòn lỗ, ăn mòn tinh giới, ăn mòn nứt do ứng lực, ăn mòn mỏi, ăn mòn lựa chọn hay sự phân rã hợp kim, ăn mòn mài mòn.
a. Ăn mòn đều, xảy ra trong điều kiện kim loại đồng nhất, môi trường, nhiệt độ và sự
phân bố ứng lực là đồng đều, tốc độ ăn mòn là như nhau trên toàn bộ bề mặt kim loại.
b. Ăn mòn tiếp xúc (galvanic), là dạng ăn mòn xảy ra khi có sự chênh lệch điện thế tạo nên một pin ăn mòn. Ăn mòn xuất hiện khi có hai hoặc nhiều kim loại có điện thế điện cực khác nhau được lắp ghép trên cùng một kết cấu, do chúng có thể tiếp xúc dẫn điện lẫn nhau và cùng nằm trong môi trường ăn mòn vì thế tạo nên một pin ăn mòn.
Ví dụ, khi chế tạo tàu thủy, phần lớn các chi tiết được làm bằng thép, vỏ tàu, bánh lái...nhưng chân vịt lại được làm bằng hợp kim đồng. Ngoài ra còn có protector bằng hợp kim kẽm hoặc nhôm, tất cả đều được lắp ghép trên một con tàu.
Dạng ăn mòn này thư ờng xuất hiện trong các hợp kim đa pha. Các pha trong hợp kim này có điện thế điện cực khác nhau, sự chênh lệch điện thế điện cực cũng gây nên ăn mòn galvanic giống như khi lắp ghép các vật liệu khác nhau trên cùng một kết cấu.
Ví dụ, các chi tiết bằng đồng thau đúc, hợp kim này cấu tạo gồm hai pha là α
giàu Cu và β giàu Zn, chúng có điện thế điện cực rất khác nhau.
Giữa các vùng trong hợp kim, sự chênh lệch nồng độ do thiên tích do ba động thành phần...cũng có thể là nguyên nhân tạo nên ăn mòn galvanic.
Hình 7.1. Ăn mòn tiếp xúc (galvanic)
c. Ăn mòn do sự chênh lệch nồng độ oxy
Ăn mòn khe là dạng ăn mòn này xảy ra có thể do môi trường không đồng nhất, chẳng hạn sự khác nhau cục bộ về thông khí hòa tan (oxy). Lúc này hình thành một pin chênh lệch khí và gây ra ăn mòn. Trong thực tế có những khe hở giữa các mặt bích, các joăng, đệm, các mối ghép bằng đinh tán, trong quá trình làm việc do chênh lệch nồng độ oxy, ở nơi nằm sâu trong khe hẹp oxy không khuếch tán tới được nên bị ăn mòn.
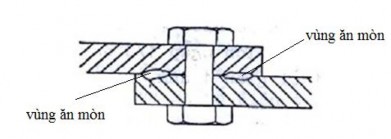
Hình 7.2. Ăn mòn khe
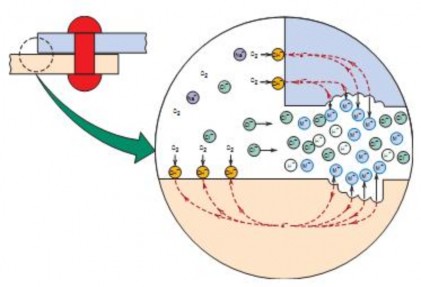
Hình 7.3. Cơ chế ăn mòn khe
Ăn mòn ở đường mím nước, lớp nước trên bề mặt giàu oxy, lớp nước sát phía
dưới nghèo oxy, do đó vật liệu bị ăn mòn tại vùng nghèo oxy theo cơ chế chênh lệch oxy.