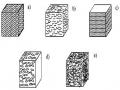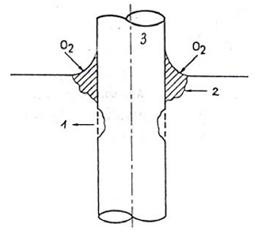
Hình 7.4. Một dạng ăn mòn mím nư ớc(1-Vùng ăn mòn, 2-Lớp gỉ sắt)
Ăn mòn chân chim dưới lớp sơn, ăn mòn chân chim ít gây tác hại, song lâu ngày có thể phát triển phá hủy từng mảng sơn và khởi đầu cho các dạng ăn mòn nguy hiểm khác. Ăn mòn chân chim thư ờng khởi đầu ở các phần lòm trên bề mặt không được tẩy sạch trước khi sơn, do đó còn đọng lại một lớp gỉ xốp hấp phụ các tạp chất, các muối hoạt tính còn đọng lại từ dung dịch làm sạch. Kim loại phía dưới bị oxy hóa tạo thành oxit trương phồng lên làm phá hủy màng sơn phía trên. Nước và oxy chui qua vùng sơn bị phá hủy nứt nẻ tạo nên cơ chế ăn mòn do chênh lệch nồng độ oxy, vùng tâm lớp gỉ nghèo oxy hơn ngoài biên bị ăn mòn.
Ăn mòn ở vùng lắng đọng, lớp cát bùn, tạp chất lắng đọng trên bề mặt cản trở oxy khuếch tán tới tạo lớp thụ động bề mặt gây nên ăn mòn do lắng đọng. Dạng ăn mòn này thường gặp ở các kết cấu cố định, song cũng có thể gặp khi các tàu neo đậu lâu ngày ở vùng nước bẩn tù đọng không được thường xuyên vệ sinh.
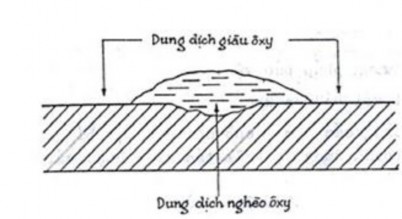
Hình 7.5. Ăn mòn ở vùng lắng đọng
d. Ăn mòn lỗ
Dạng ăn mòn này thường xảy ra đối với các kim loại và hợp kim có tính thụ động ăn mòn như: Fe, Cr, Al, Ni...các loại thép không gỉ trong môi trường có các anion Cl-, Br-, I- (halogen) bị ăn mòn cục bộ dẫn đến tạo ra các lỗ.
Đây là dạng xâm thực cục bộ tạo nên các lỗ, độ sâu các lỗ có thể lớn hơn đường
kính lỗ. Hiện tượng này xảy ta do các lỗ nhỏ trong lớp phủ bảo vệ chống ăn mòn đ ều (các lớp men, lớp phủ hữu cơ, màng oxyt...). Các lỗ phát triển từ trên bề mặt vào bên trong theo các hướng gần như thẳng góc.


Hình 7.6. Các dạng ăn mòn lỗ
Cơ chế ăn mòn lỗ cũng tương tự như cơ chế ăn mòn do sự chênh lệch nồng độ oxy rong môi trường gây ra.
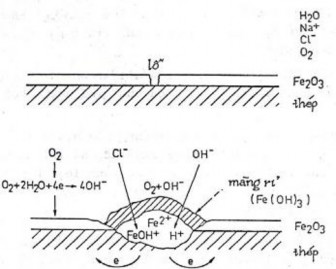
Hình 7.7. Ăn mòn lỗ của thép thụ động trong ion Cl-
Ở vùng đấy lỗ nghèo oxy do đó bị ăn mòn và là anot, các vùng khác là catot. Do hiện tượng điện di, các anion Cl- di chuyển đến anot gây nên hiện tượng tập trung anion Cl- ở vùng đáy lỗ, làm mất khả năng tái thụ động, do đó ăn mòn tăng lên. Lỗ càng sâu, vùng đáy lỗ càng nghèo oxy càng gây nên ăn mòn.
e. Ăn mòn tinh giới
Dạng ăn mòn này liên quan đế sự có mặt của các pha dị thể ở biên giới hạt trong hợp kim. Loại ăn mòn này thư ờng gặp nhất ở thép không rỉ vì thép không gỉ được hợp kim với lượng Cr trên 12%, với lượng này có ảnh hưởng quan trọng đến quá trình ăn mòn của thép. Với hàm lượng Cr trên 12% thì màng oxit Cr2O3 xít chặt, tăng lượng Cr thì tốc độ ăn mòn giảm. Tuy nhiên do hiện tượng tiết cacbit Cr làm xuất hiện vùng nghèo Cr ở lân cận biên giới hạt, do đó thép bị ăn mòn.

Hình 7.8. Ăn mòn tinh giới của thép không rỉ.
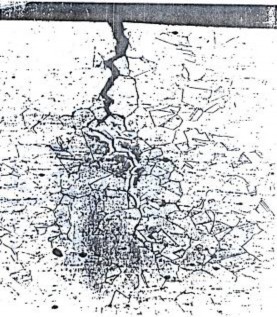
Hình 7.9. Ăn mòn nứt ở biên giới hạt thép không rỉ
f. Ăn mòn nứt do ứng lực
Các kết cấu kim loại làm việc trong môi trường ăn mòn , dưới tác dụng của lực kéo sẽ gây ra nứt, rạn và gãy. Dạng ăn mòn này gây tổn thất kim loại rất nhỏ, nhưng khó có thể nhìn thấy nên rất nguy hiểm.
Hình 7.10. Ăn mòn do ứng lực
g. Ăn mòn mỏi
Là hiện tượng ăn mòn xảy ra trong các kết cấu kim loại làm việc dưới tải trọng thay đổi có chu kỳ. Do tác dụng ăn mòn tạo điều kiện cho các vết nứt mỏi đầu tiên dễ xuất hiện hơn.
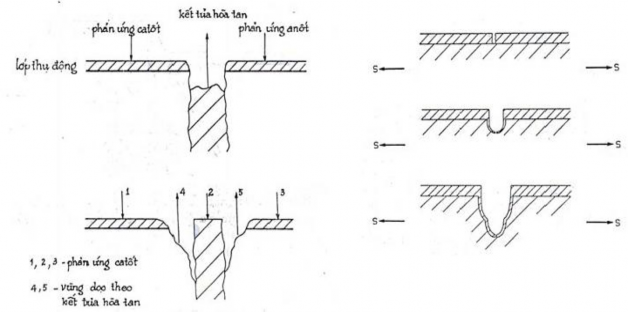
h. Ăn mòn lựa chọn (sự phân rã hợp kim)
Dạng ăn mòn này xảy ra trong các điều kiện nhất định đối với các hợp kim là dung dịch rắn, trong đó kim loại hòa tan có điện thế ăn mòn âm hơn nhiều so với kim loại nền.
Hình 7.11. Ăn mòn lựa chọn (sự phân rã của hợp kim)
k. Ăn mòn mài mòn
Sự mài mòn của kim loại thụ động trong môi trường ăn mòn có thể làm mất lớp bảo vệ và hiện tượng này gọi là ăn mòn mài mòn.


a) b)
Hình 7.12. Ăn mòn mài mòn
a. Ăn mòn cục bộ do chảy rối của chất lỏng trong ống ngưng
b. Ăn mòn mài mòn do sự sủi bọt ở nước làm lạnh trong xylanh
7.3. Bảo vệ chống ăn mòn
Để bảo vệ kim loại chống ăn mòn, có ba phương pháp cơ bản:
Sơn phủ bề mặt để cách ly chi tiết với môi trường ăn mòn phương pháp này rẻ nhưng chỉ bảo vệ được lớp mặt.
Hợp kim hóa giảm ăn mòn (ví dụ bằng Cr) các nguyên tố hợp kim sẽ làm tăng điện thế ăn mòn của các pha, làm giảm khả năng bị ăn mòn. Phương pháp này không kinh tế vì phải hợp kim hóa toàn khối.
Bảo vệ điện hóa để cho quá trình ăn mòn xảy ra nhưng điều khiển quá trình ăn
mòn theo hướng có lợi, hoặc tác động vào môi trường để ngăn cản quá trình ăn mòn.
7.3.1. Sơn phủ
Cách ly môi trường với kim loại bằng một lớp màng. Màng phải liên tục, bán chắc lên bề mặt chi tiết và trơ với môi trường. Cần chuẩn bị bề mặt thật sạch, không còn có các vết oxyt, dầu mỡ...
a. Phủ phi kim
- Sơn phủ dùng bitum là phương pháp cổ điển, dùng cho ống chôn sâu.
- Sơn polyme là phương pháp phổ biến thường dùng hai lớp sơn, lớp trong là lớp lót có tác dụng ngăn cách chi tiết với môi trường, đồng thời cũng đảm bảo cho sơn bám chắc vào chi tiết, ngoài là lớp sơn đảm bảo thẩm mỹ. Sơn gồm có bột oxyt, bột Zn, Al, kim loại anôt hoặc chất đóng vai trò ức chế như cromat kẽm và chất đóng vai trò dính kết như polyme, dầu khô nhanh như dầu sơn, dầu trấu...
- Chất liệu sơn cũng có nhiều phong phú trước đây dùng sơn dầu có chứa PbO, ngày
nay có cả sơn acrylic cơ sở nước thuận tiện sử dụng.
- Phương pháp sơn có nhiều tiến bộ từ nhúng, quét, lăn, phun cao áp, ngày nay có sơn
tĩnh điện, phun hạt tích điện.
- Tráng men dùng hạt thủy tinh borosilicat-frit cho bao ngoài kim loại rồi nung để
thiêu kết và bám dính, sau khi nung lớp men có độ cứng cao nhưng dòn.
b. Phủ mạ kim loại
Tạo một lớp kim loại ở bề mặt chi tiết bằng các cách nhúng trong kim loại nóng chảy (mạ nóng), mạ bằng điện, mạ hóa, phun kim loại (kim loại hóa), hàn, cán.
Mạ điện kim loại dùng để mạ là Zn, Ni, Cr, Cu. Chi tiết đóng vai trò catôt và anôt là kim loại cần mạ.
Mạ nóng nung chảy kim loại mạ đến nhiệt độ cần thiết rồi nhúng chi tiết cần mạ vào bể kim loại lỏng.
c. Phủ bằng phương pháp hóa học
Nhuộm đen, nung thép đến nhiệt độ 350-4500 rồi nhúng vào dầu khoáng vật, bề mặt chi tiết được phủ một lớp oxyt mảng có màu đen ở bề mặt thép. Phương pháp thông dụng là nhuộm đen thép trong hỗn hợp muối nóng chảy có tỉ lệ 1:1 của KNO2+ KNO3 hoặc NaNO2+NaNO3 + NaOH2 ở nhiệt độ 310-3500C sau đó rửa sạch bằng nước lạnh, tiếp theo là nước nóng có 2% xà phòng cuối cùng là rửa bằng nước lạnh.
Nhúng chi tiết thép vào bể chứa dung dịch Mn(H2PO4)2 và Fe(H2PO4)2 với nước nóng để tạo ra lớp photphat sắt màu xám đen khá xít chặt ở bề mặt.
7.3.2. Bảo vệ điện hóa
a. Bảo vệ catôt
Chi tiết cần bảo vệ đóng vai trò là một catôt.
Nguyên lý dùng một kim loại M’ có điện thế ăn mòn âm hơn chi tiết M để làm anôt. Trong quá trình ăn mòn, anôt M’ s ẽ bị ăn mòn và vật thật sẽ được bảo vệ. Ví dụ: để bảo vệ thép dùng kim loại có điện thế âm hơn như Zn, Al, Mg để làm anôt hy sinh gọi là protector.
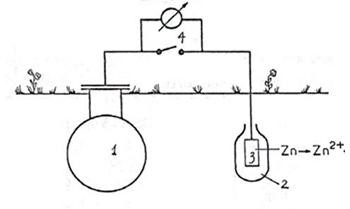
Hình 7.13. Bảo vệ catốt bằng protector
1. Thiết bị cần bảo vệ
2. Chất bọc protector
3. Proctector Zn
4. Dụng cụ kiểm tra
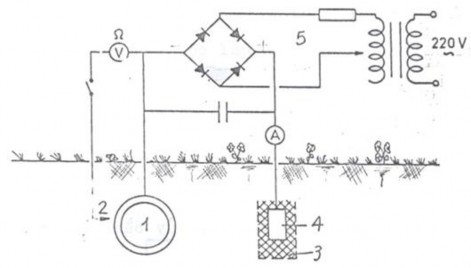
Hình 7.14. Sơ đồ bảo vệ ống dẫn dưới đất bằng dòng điện ngoài
Với những công trình nhỏ nên dùng bảo vệ bằng protectơ vì giá thành thấp hơn.
- Bảo vệ bằng dòng điện ngoài thường dùng cho các diện tích rất lớn.
- Thường xuyên kiểm tra bảo dưỡng đúng định kỳ.
- Các phương pháp bảo vệ catôt thường dùng kết hợp các lớp bảo vệ cách điện: sơn,
bọc nhựa đường, chất dẻo...
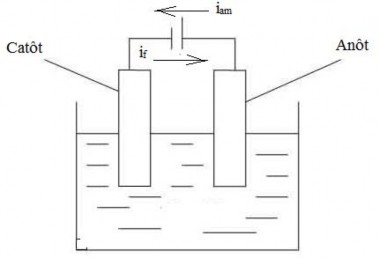
b. Dùng anôt trơ graphit
Nguyên lý là dùng anôt trơ để tạo ra dòng điện ngược chiều trong mạch điện ăn
mòn do đó sẽ giảm được dòng ăn mòn tuy nhiên khó đi ều chỉnh dòng.
Hình 7.15. Nguyên lý dùng anôt trơ
c. Bảo vệ anôt
Phương pháp này chỉ dùng cho kim loại có khả năng thụ động hóa. Cần trang thiết bị phức tạp, chỉ dùng trong ăn mòn cực cao, trong công nghiệp hóa học.
7.3.3. Ăn mòn hóa học
7.3.3.1. Khái niệm và phân loại
Ăn mòn hóa học là quá trình ăn mòn xảy ta khi kim loại tác dụng với dung dịch
không điện ly và khí khô.
Ăn mòn trong dung dịch không điện ly, đa số các chất hữu cơ không là chất điện ly, do vậy chúng không dẫn điện nên không xảy ra ăn mòn điện hóa.
Ăn mòn khí, là quá trình ăn mòn hóa học xảy ra trong khí khô ở nhiệt độ cao. Ví dụ, sự oxy hóa các chi tiết trong lò nung, động cơ đốt trong, động cơ phản lực...
Ăn mòn khô chủ yếu do phản ứng oxy hóa:
+ Tạo thành oxyt do tác dụng với oxy trong không khí
+ Tọa sulfua do SO2
+ Tác động của Cl, Be, CO, CO2, H2O.
Đánh giá sự oxy hóa bằng ái lực (∆H0 kJ/mol O2) của kim loại đối với oxy hoặc đối với lưu huỳnh.
Bảng 7.2. Ái lực của một số kim loại đối với oxy và lưu huỳnh
Oxyt | ∆H0 | Hợp chất | ∆H0 | |
Ag | Ag2O | -60 | Ag2S | -185 |
Cu | Cu2O | -335 | Cu2S | -270 |
Ni | NiO | -490 | Ni2S | -330 |
Fe | FeO | -520 | FeS | -310 |
Cr | Cr2O3 | -750 | CrS | -200 |
Al | Al2O3 | -1080 |
Có thể bạn quan tâm!
-
 Tính Chất Gia Công Của Vật Liệu Polyme
Tính Chất Gia Công Của Vật Liệu Polyme -
 Sơ Đồ Minh Họa Cấu Tạo Compozit
Sơ Đồ Minh Họa Cấu Tạo Compozit -
 Sơ Đồ Sắp Xếp Các Lớp Cơ Sở Khi Tạo Ra Compozit Cấu Trúc Dạng Lớp
Sơ Đồ Sắp Xếp Các Lớp Cơ Sở Khi Tạo Ra Compozit Cấu Trúc Dạng Lớp -
 Vật liệu kỹ thuật 2 - 23
Vật liệu kỹ thuật 2 - 23
Xem toàn bộ 193 trang tài liệu này.
Quá trình ăn mòn khí xảy ra do tác động đồng thời của nhiệt độ cao và các khí ăn mòn xâm thực vào kim loại. Tốc độ ăn mòn phụ thuộc vào tính chất kim loại và hợp kim, tính chất của môi trường khi ở nhiệt độ cao và tính chất của các sản phẩm ăn mòn.
7.3.3.2. Bảo vệ chống ăn mòn hóa học
Dùng hợp kim chịu nóng thường dùng các loại hợp kim của Fe có Cr là nguyên tố hợp kim. Trong hợp kim tạo lớp oxyt đặc chắc, bám dính và có khả năng bảo vệ tốt, hợp kim giữ được độ bền ở nhiệt độ cao.
Muốn vật liệu chịu nhiệt độ cao hơn nữa thì dùng gốm ceramic
Phủ mạ phủ lớp Cr, Ni lên thép rồi ủ khuếch tán, phun phủ gốm lên bề mặt chi tiết bằng năng lượng plasma. Các phương pháp phủ mạ bốc hơi là phủ mạ bốc hơi vật lý (PVD) và phủ mạ bốc hơi hóa học (CVD). Các quá trình phủ mạ đều gồm ba bước: tạo chất phủ mạ, vận chuyển chất phủ từ nguồn tới vật liệu phủ, phát triển màng chất phủ.
7.4. Ăn mòn khô và cách chống ăn mòn khô
Ăn mòn khô của các kim loại là phản ứng giữa kim loại và khí bao quanh chúng. Phản ứng này là sự oxy hóa xảy ra trên bề mặt kim loại và tạo thành với nó một số hợp chất nào đó. Do đó kim loại lại bị phá hủy. Loại ăn mòn này chủ yếu xảy ra ở nhiệt độ cao. Trong đa số trường hợp, oxy của khí quyển tác dụng với kim loại tạo thành các oxyt.