không đóng góp đến mức hóa trị V1. Mức hoá trị V2 từ -22,5 đến -20 eV do sự đóng góp của điện tử 2s của oxy và 5p của La vì thế hai trạng thái này chỉ ra một sự lai hoá mạnh. Trong khi đó, mức hoá trị V3 gần -18 eV do sự đóng góp của điện tử 5p của La và 2s của oxy. Chú ý rằng các điện tử 5s, 5p, 6s và 6d của La ít đóng góp vào V4. Điện tử 6d của La chủ yếu đóng góp vào mức dẫn (conductibity band, VB).
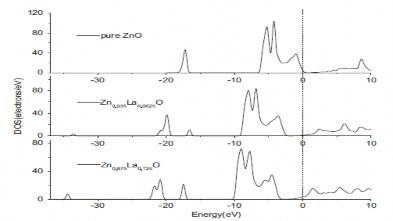
Hình.1.8. Mật độ trạng thái theo mô phỏng lý thuyết hàm mật độ của ZnO và ZnxLa(1-x)O với x = 0,0625 và 0,125 [42]
Zamiri và cộng sự [174] đã nghiên cứu phổ Raman của ZnO có pha tạp một số nguyên tố đất hiếm (M - ZnO) (M = Er, La và Yb) nhận thấy rằng các kiểu phonon (phonon modes) của các vật liệu M - ZnO không thay đổi nhiều so với ZnO.
Qua kết quả tổng quan trên cho thấy rằng, nhóm vật liệu La - ZnO rất đa dạng về hình thái cũng như tính chất vật lý. Xuất phát từ điều kiện nghiên cứu ở phòng thí nghiệm trường Đại Học Khoa Học Huế, chúng tôi lựa chọn phương pháp thuỷ nhiệt để nghiên cứu tổng hợp vật liệu nano La - ZnO dạng sợi và các yếu tố ảnh hưởng đến quá trình tổng hợp sẽ được thảo luận.
1.3. ỨNG DỤNG ZnO VÀ La – ZnO TRONG XÚC TÁC QUANG HÓA PHÂN HỦY PHẨM NHUỘM
Oxy hoá không khí ướt (Wet Air Oxidation) (WAO) là phương pháp oxy hoá các chất hữu cơ lơ lửng cũng như các chất vô cơ dạng khử với oxy hay không khí trong điều kiện nhiệt độ và áp suất cao. Ứng dụng của WAO truyền thống bị giới hạn do điều kiện vận hành của nó đòi hỏi nhiệt độ cao và áp suất cao trong thời gian dài [105]. Oxy hoá không khí ướt xúc tác (Catalytic Wet Air Oxidation) (CWAO) là một kỹ thuật phát triển từ những năm 1970. Quá trình này có thể tăng tốc độ phản ứng, hạ thấp nhiệt độ
và áp suất nhờ chất xúc tác. Trong những năm gần đây, quá trình oxy hoá nâng cao (advanced oxidation processes) đã được quan tâm nghiên cứu nhiều. Nó được cho là phương pháp có triển vọng để thay thế các phương pháp WAO và CWAO do khả năng oxy hoá cao các chất hữu cơ bằng cách tạo ra các gốc OH.
Ứng dụng sóng siêu âm (ultrasound) khác với nguồn năng lượng khác như nhiệt, ánh sáng hay bức xạ ion đã trở nên phổ biến trong việc phân huỷ chất hữu cơ với tần số từ 20 - 1000 kHz. Hoá học siêu âm môi trường (Enviromental sonochemistry) đã phát triển nhanh chóng trên cơ sở áp dụng sóng siêu âm. Lỗ trống sóng âm (acoustic cavitation) là yếu tố chủ yếu để phân huỷ chất hữu cơ ô nhiễm [28]. Khi chất lỏng được siêu âm, các phân tử khí hoà tan bị bẫy trong các vi bọt (micro - bubbles) giãn ra theo một chu kỳ co giãn của sóng âm; kết quả các vi bọt tạo ra một nhiệt độ rất cao khi sụp đổ đoạn nhiệt [89, 152]. Quá trình này dựa trên một hiện tượng gọi là lỗ trống sóng âm (cavitation) liên quan đến sự hình thành, lớn lên và sụp đổ tức thời của các vi bọt. Các lỗ trống này có thời gian tồn tại ngắn, nhiệt độ và áp suất cao [68, 189]. Nhiệt độ cao (5000K) và áp suất (1000 atm) gây ra bởi các lỗ trống khi bọt khí sụp đổ trong dung dịch đã dẫn đến sự phân ly phân tử nước [37].
Có thể bạn quan tâm!
-
 Tổng hợp nano kẽm oxít có kiểm soát hình thái và một số ứng dụng - 2
Tổng hợp nano kẽm oxít có kiểm soát hình thái và một số ứng dụng - 2 -
 Cấu Trúc Wurtzite Và Blende Của Zno
Cấu Trúc Wurtzite Và Blende Của Zno -
![Hình Thái Của Vật Liệu Zno Nano/micro Dạng Que Hình Thoi: A. Ảnh Sem; B. Ảnh Tem, C. Ảnh Hrtem (Ảnh Sead Nằm Góc Bên Phải) Của Micro Zno Hình Thoi [177]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Hình Thái Của Vật Liệu Zno Nano/micro Dạng Que Hình Thoi: A. Ảnh Sem; B. Ảnh Tem, C. Ảnh Hrtem (Ảnh Sead Nằm Góc Bên Phải) Của Micro Zno Hình Thoi [177]
Hình Thái Của Vật Liệu Zno Nano/micro Dạng Que Hình Thoi: A. Ảnh Sem; B. Ảnh Tem, C. Ảnh Hrtem (Ảnh Sead Nằm Góc Bên Phải) Của Micro Zno Hình Thoi [177] -
 Tổng Quan Một Số Kết Quả Nghiên Cứu Cảm Biến Khí H2, Nh3 Và C2H5Oh Bằng Vật Liệu Bán Dẫn Trong Những Năm Gần Đây
Tổng Quan Một Số Kết Quả Nghiên Cứu Cảm Biến Khí H2, Nh3 Và C2H5Oh Bằng Vật Liệu Bán Dẫn Trong Những Năm Gần Đây -
 Một Số Công Trình Đã Được Công Bố Ứng Dụng Zno Để Xác Định Một Số Hợp Chất Hữu Cơ Bằng Phương Pháp Điện Hóa
Một Số Công Trình Đã Được Công Bố Ứng Dụng Zno Để Xác Định Một Số Hợp Chất Hữu Cơ Bằng Phương Pháp Điện Hóa -
 Giản Đồ Mức Năng Lượng Chỉ Ra Những Trạng Thái Liên Quan Đến Phổ Raman
Giản Đồ Mức Năng Lượng Chỉ Ra Những Trạng Thái Liên Quan Đến Phổ Raman
Xem toàn bộ 207 trang tài liệu này.
Về nguyên tắc, đa số các phẩm nhuộm có thể bị mất màu và khoáng hoá bằng sóng siêu âm, nhưng tốc độ phân huỷ rất chậm để có thể ứng dụng trong thực tiễn. Vì thế có nhiều nghiên cứu cải thiện vấn đề này, một trong những phương pháp thông thường nhất là thêm chất xúc tác vào dung dịch trong điều kiện chiếu xạ sóng siêu âm. Một vài nghiên cứu sử dụng chất xúc tác bán dẫn như TiO2 hay ZnO [152], Au/TiO2 [152], MnO2 [58] với sự chiếu xạ UV. Sự hiện diện của chất xúc tác cơ bản làm gia tăng sự hình thành lỗ trống sóng âm bằng cách thêm vào các tác nhân mà nó sẽ tăng sự hình thành OH [135]. Trong trường hợp xúc tác dị thể, hiện tượng huỳnh quang siêu âm (sonoluminesence) hay điểm nóng (hot spot) là có thể do sự hình thành OH. Huỳnh quang siêu âm gây ra sự sụp đổ các vi bọt cộng với chiếu xạ UV (ultra-violete) cường độ cao (200 - 500nm) [152]. Sự thêm vào các chất bắt gốc OH (scavenging agents) làm giảm đáng kể tốc độ phân huỷ phẩm nhuộm, chứng tỏ OH đóng vai trò quan trọng trong việc phân huỷ phẩm nhuộm chất hữu cơ bằng siêu âm [135, 152].
Gần đây, để tăng cường nguồn OH, người ta sử dụng thêm H2O2 được đưa vào trong quá trình siêu âm cùng với chất xúc tác, như vậy đây thực chất là một quá trình
CWAO dùng H2O2 với sự hỗ trợ của sóng siêu âm (Ultrasonically assisted catalytic hydroperoxide oxidation process) [48] (từ đây ký hiệu là UAHC). Apostolos và cộng sự [11] đã sử dụng UAHC để oxy hoá phenol với xúc tác Al-Fe/đất sét. Kết quả nghiên cứu động học cho thấy, sóng siêu âm tăng cường khuếch tán trong. Hệ số khuếch tán tăng theo hàm bậc hai so với điều kiện không có sóng siêu âm. Một sự so sánh động học của quá trình oxy hoá phenol bằng UAHC với xúc tác ReI3 trong điều kiện có sóng siêu âm và không có sóng siêu âm đã được công bố [131]. Sự so sánh cho thấy, năng lượng hoạt hoá của quá trình này khi có sóng siêu âm chỉ là 13 kJ.mol-1 bằng 1/4 với trường hợp không dùng sóng siêu âm (57 kJ.mol-1). Kết quả này cho thấy sóng siêu âm đã tăng cường đáng kể tốc độ phản ứng oxy hóa phenol.
Đa số các nghiên cứu về CWAO đều tập trung loại bỏ chất ô nhiễm, COD hay TOC. Tuy nhiên, kiến thức đầy đủ về cơ chế hay động học của quá trình này là chìa khoá để tối ưu hoá điều kiện phản ứng và sử dụng chất xúc tác một cách có hiệu quả để có thể ứng dụng trong thực tiễn. Hầu hết các nghiên cứu đều cho rằng phản ứng hoá học của CWAO chủ yếu là quá trình trên cơ sở các phản ứng tạo ra gốc tự do. Các phản ứng tạo ra gốc tự do bao gồm phản ứng khơi mào, phát triển và ngắt mạch đã được đề nghị xảy ra trong quá trình WAO đối với một số chất hữu cơ [100]. Robert và cộng sự [130] đã cung cấp một bằng chứng về sự hiện diện các gốc tự do trung gian trong quá trình WAO của cellulose dùng phổ cộng hưởng spin điện tử (electron spin resonance spectroscopy) và xúc tác dị thể có khả năng tạo ra gốc tự do. Chất xúc tác sẽ hoạt hoá trực tiếp các phân tử chất hữu cơ, để chúng dễ dàng phân huỷ thành các gốc mới hay tăng cường sự phân tách thành gốc tự do với hydroperoxide tạo thành cơ chế chuỗi gốc tự do.
Chu trình xúc tác có thể thực hiện thông qua quá trình oxy hoá khử của hydroperoxide
ROOH + Mn+→ ROO• + M(n−1)+ +H+ (1.3)
ROOH + M(n−1)+→ RO• + Mn+ +OH− (1.4)
Chất xúc tác rắn tăng cường sự phân ly gốc tự do thông qua sự tạo thành gốc alkyl; peroxy như phản ứng (1.3) và sự phân huỷ hydroperoxide ở phản ứng (1.4). Thế oxy hoá khử của cặp Mn+/M(n-1)+ là yếu tố chính quyết định sự oxy hoá.
Xúc tác cũng liên quan đến cơ chế chuyển dịch oxygen, trong đó vai trò chất xúc tác là để chuyển oxy nguyên tử đến phân tử tác chất thông qua sự tạo phức và hoạt hoá [27]. Sự CWAO của các chất hữu cơ có thể được khởi đầu bằng hoạt hoá cả phân tử oxygen lẫn phân tử tác chất. Cả hai loại oxygen hấp phụ lên bề mặt xúc tác và oxygen trong mạng lưới oxide đều có thể tham gia vào quá trình oxy hoá [27]. Trong trường hợp này, cơ chế kiểm soát phản ứng là các gốc tự do, sử dụng hydroperoxide hay ozone có thể tăng tốc độ phản ứng phân huỷ vì tạo ra thêm gốc tự do. Phản ứng phân ly thuận nghịch của hydroperoxide giải phóng ra gốc tự do cũng đã được biết đến. Mặc dù sự kết hợp sóng siêu âm với hydroperoxide có thể hứa hẹn một khả năng gia tăng gốc tự do, nhưng các nghiên cứu theo hướng này theo sự hiểu biết của chúng tôi là không có nhiều. Điều này có thể là do nồng độ của hydroperoxide đóng một vai trò quan trọng trong phạm vi phân huỷ chất hữu cơ. Một mặt, hydroperoxide có thể hoạt động như nguồn tạo ra gốc tự do bằng quá trình tự phân ly, mặt khác nó cũng hoạt động như chất tiêu diệt (scavenger) các gốc tự do mới tạo ra, như theo sơ đồ phản ứng sau:
HO+ H2O2 H2O + HO2(1.5)
Vì thế, ảnh hưởng của quá trình tổng thể sẽ phụ thuộc nhiều vào việc sử dụng gốc tự do của các phân tử hữu cơ, hay phụ thuộc hiệu quả tiếp xúc của gốc tự do với chất hữu cơ ô nhiễm. pH, tốc độ khuấy, bản chất (ưa nước hay kỵ nước) của chất hữu cơ ô nhiễm, nồng độ của nó là những yếu tố ảnh hưởng chủ yếu đến sự chọn lựa kết hợp sóng siêu âm với hydroperoxide. Chen và cộng sự [34] đã nghiên cứu phân huỷ chloroform bằng kỹ thuật CWAO có sự kết hợp với sóng siêu âm. Tỉ lệ mol hydroperoxide : chloroform xấp xỉ bằng 30 là tối ưu, nhưng khi tăng lên tỉ lệ đó lên 120 thì tốc độ phân huỷ lại giảm. Ngoài xúc tác CuO được cho là xúc tác có hiệu quả cho hệ CWAO kết hợp sóng siêu âm thì Al2O3, ZnO và Ni2O3 cũng đã và đang được nghiên cứu trong hệ này [61].
Trong đa số trường hợp, chất xúc tác quang hoá là chất bán dẫn. Khi ánh sáng chiếu vào chất bán dẫn, các điện tử ở trong vùng hoá trị có thể nhảy lên vùng dẫn. Kết quả tạo ra một cặp điện tử - lỗ trống dương (photoinduced electron-hole pairs) (gọi là cặp điện tử - lỗ trống quang sinh). Vật liệu có hoạt tính quang xúc tác càng cao khi sự tái kết hợp cặp điện tử và lỗ trống quang sinh này xảy ra càng chậm. Mục đích của
phản ứng quang hoá xúc tác là có phản ứng giữa điện tử quang sinh này với chất oxy hoá để tạo ra sản phẩm khử và cũng có phản ứng giữa lỗ trống quang sinh với tác nhân khử để tạo ra sản phẩm oxy hoá. Do sự tạo ra lỗ trống dương và điện tử, phản ứng oxy hoá khử xảy ra tại bề mặt của chất bán dẫn. Trong phản ứng oxy hoá, lỗ trống phản ứng với nước ẩm trên bề mặt tạo ra gốc hydroxyl tự do. Hình 1.9 minh hoạ sơ đồ phản ứng xúc tác quang hoá.
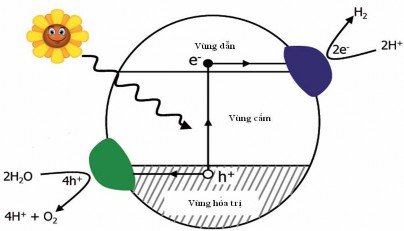
Hình 1.9. Sơ đồ minh hoạ xúc tác quang hoá
Phản ứng oxy hoá do hiệu ứng quang xúc tác là:
UV (Ultra violet) + MO → MO (h+/ e−) (1.6)
Ở đây, MO là oxide và h+ là lỗ trống dương
h+ + H2O → H+ + •OH (1.7)
2 h+ + 2 H2O → 2 H+ + H2O2 (1.8)
H2O2→ HO• + •OH (1.9)
Phản ứng khử do hiệu ứng xúc tác là:
e− + O2 → •O2 (1.10)
•O2− + HO•2 + H+ → H2O2 + O2 (1.11)
HOOH → HO• + •OH (1.12)
Cuối cùng, gốc tự do hydroxyl được tạo ra trong cả hai phản ứng. Gốc tự do hydroxyl có khả năng oxy hoá rất cao và không chọn lọc với thế oxy hoá khử E0 =
+3.06 V [40]. Đây là một trong những vật liệu có thế oxy hoá khử dương nhất được
biết hiện nay.
Xúc tác quang hoá dùng chất bán dẫn đã được dùng để xử lý môi trường [26, 147]. Trong số các chất bán dẫn, TiO2 đã được sử dụng thương mại như là chất xúc tác quang hoá để xử lý môi trường. Tuy nhiên, ZnO là loại vật liệu có thể thay thế TiO2 bởi vì có năng lượng vùng cấm tương tự (3,2 eV) với hiệu ứng lượng tử tương đối cao [17]. Nhiều công bố cho rằng ZnO có hiệu ứng quang xúc tác cao hơn TiO2 trong một số điều kiện [9, 34, 172]. Chất xúc tác trên cơ sở ZnO được nhiều nhà khoa học quan tâm vì các tính chất đặc biệt của nó như ổn định hoá học cao, không độc, rẻ tiền và có nhiều trong tự nhiên. Tuy nhiên, ZnO vẫn có những nhược điểm như có tốc độ tái kết hợp nhanh các điện tử và lỗ trống quang sinh, hiệu suất lượng tử thấp trong phản ứng quang hoá trong dung dịch, do đó hoạt tính xúc tác quang hoá của ZnO cần phải được cải thiện rất nhiều mới có thể đáp ứng yêu cầu xử lý môi trường. Để cải thiện hoạt tính xúc tác, nhiều loại kim loại hay oxide kim loại đã được pha tạp vào ZnO để ức chế sự tái kết hợp của điện tử và lỗ trống sinh ra do quang hóa [182]. Một số nghiên cứu liên quan đến vấn đề này như La - ZnO làm xúc tác phân huỷ monocrophos [10], phân huỷ 2,4,6-trichlorophenol [9], Nd-ZnO làm xúc tác quang hoá cho phản ứng phân huỷ C. I
Reactive Blue 4 [187], Ce - ZnO xúc tác quang hoá phân huỷ acid orange II [173], Ta - ZnO phân huỷ methylene blue [78], (La3+, Nd3+,Sm3+)-ZnO làm xúc tác quang phân huỷ 4-nitrophenol [74]; Bi - ZnO làm xúc tác quang hoá cho phản ứng phân huỷ methyl da cam [185].
Theo sự hiểu biết của chúng tôi, hiện nay có ít công trình công bố về sự phân huỷ chất hữu cơ ô nhiễm dùng chất xúc tác quang hoá La - ZnO. Jia và cộng sự [71] đã nghiên cứu sự phân huỷ Rhodamine B bằng xúc tác quang hoá La - ZnO. Kết quả cho thấy La - ZnO có khả năng phân huỷ quang hoá cao hơn ZnO và nồng độ pha tạp La khoảng 2% cho hiệu quả xúc tác tốt nhất. Họ giải thích rằng, khi La3+ phân tán vào sẽ tạo ra nhiều khuyết tật bề mặt hơn và một lớp tích điện không gian (space charge layer)
có thể hình thành trên bề mặt và có thể ngăn cản sự tái kết hợp cặp điện tử - lỗ trống quang sinh, kết quả nâng cao khả năng xúc tác quang hoá của La - ZnO. Anandan và cộng sự [10] cho thấy rằng La - ZnO có thể khoáng hoá hoàn toàn monocrotophos trong dung dịch. Hiệu suất lượng tử của La - ZnO cao hơn của nano TiO2. Hiệu suất khoáng hoá tăng khi nồng độ La pha tạp trong La - ZnO tăng đến 0,8 % khối lượng sau đó giảm dần khi tiếp tục tăng lượng La. Động học phản ứng phân huỷ tuân theo động học hình thức bậc nhất; hiệu suất khoáng hoá cao hơn nano TiO2. Chlorophenol hoặc
2,4,6-trichlorophenol cũng có thể bị phân huỷ bằng chất xúc tác quang hoá La - ZnO [9]. Họ đã nghiên cứu sự phân huỷ chlorophenol bằng xúc tác quang hoá dưới ánh sáng UV có bước sóng khác nhau (254 nm và 365 nm). Kết quả cho thấy La - ZnO có hiệu suất lượng tử cao hơn TiO2 và có khả năng khoáng hoá hoàn toàn chlorophenol. Khatamian và cộng sự [74] đã nghiên cứu sự phân huỷ 4-nitrophenol trên chất xúc tác M - ZnO, M = Sm3+, La3+, Nd3+ cho thấy sự pha tạp La vào ZnO có thể làm cho phản ứng quang hoá đạt đến độ khoáng hoá hoàn toàn các dẫn xuất phenol trong thời gian chiếu xạ rất ngắn.
Trong luận án này, chúng tôi sẽ nghiên cứu động học phân huỷ methyl xanh của xúc tác ZnO có sự hỗ trợ của sóng siêu âm và phản ứng phân hủy methyl xanh dùng chất xúc tác quang hoá ZnO và La - ZnO.
1.4. ỨNG DỤNG La – ZnO LÀM CẢM BIẾN KHÍ
1.4.1. Cơ sở lý thuyết
Vật liệu mà có sự thay đổi một số tính chất phụ thuộc vào môi trường khí xung quanh có thể dùng làm vật liệu cảm biến khí. Sự thay đổi thường gặp nhất là sự thay đổi độ dẫn điện khi đặt nó trong môi trường khí cần phát hiện. Nhiều oxide kim loại phù hợp cho việc phát hiện các khí khử, dễ cháy hay có tính acid - base đặc trưng. Trong số này phổ biến nhất là SnO2 và ZnO [16]. Các oxide tinh khiết như ZnO hay SnO2 tự thân đã có hoạt tính cảm biến, tuy nhiên để nâng cao hoạt tính cảm biến của chúng người ta thường pha tạp vào nó một số kim loại hoặc oxide kim loại.
Đa số các sensor ZnO và SnO2 làm việc ở nhiệt độ từ 300 – 400 oC. Cơ chế chính
xác gây ra sự cảm biến khí vẫn đang còn tranh cãi. Nhưng vấn đề bẫy điện tử tại các phân tử bị hấp phụ và sự trộn lẫn năng lượng gây ra bởi các phân tử tích điện dẫn đến sự thay đổi tính dẫn điện của vật liệu cảm biến đã được chấp nhận rộng rãi. Khi một phân tử khí hấp phụ lên bề mặt chất bán dẫn các điện tử có thể chuyển đến phân tử này nếu orbital phân tử bị chiếm thấp nhất của mức hấp phụ nằm trên mức Fermi (mức nhận) của chất rắn. Ngược lại điện tử sẽ chuyển về chất rắn nếu orbital bị chiếm cao nhất nằm trên mức Fermi của chất rắn (mức cho). Vì thế, sự hấp phụ phân tử có thể tạo ra điện tích trên bề mặt gây ra một điện trường và chúng sẽ tạo ra sự trộn các mức năng lượng trong chất rắn. Một điện tích bề mặt âm sẽ trộn với mức năng phía trên, nghĩa là đẩy mức Fermi vào vùng cấm của chất rắn, làm giảm nồng độ chất tích điện một cách có hiệu quả và tạo ra vùng kiệt điện tử (electron
depleption zone). Sự kiệt điện tử này gây ra một không gian tích điện dương và nó sẽ bù trừ với điện tích âm của bề mặt.
(a)
(b)
Hình 1. 10. a. Sơ đồ minh hoạ sự trộn lẫn các vùng năng lượng trong khu vực gần bề mặt của chất bán dẫn; b. Sơ đồ minh hoạ mật độ điện tích trong hạt SnO2 [16]
Trong vật liệu cảm biến khí đa tinh thể, có một ảnh hưởng liên quan đến sự trộn lẫn các vùng năng lượng trên bề mặt và thường được cho là đóng góp đến sự gia tăng hoạt tính cảm biến. Hiệu ứng này là do sự tạo thành rào cản Schottky (Schottky barrier) tại các biên hạt [98]. Hình 1.10 trình bày hiệu ứng này tại biên hạt, sự trộn lẫn hướng lên trên do tích điện bề mặt, kết quả sẽ hình thành một rào cản mà tại đó các điện tử dẫn phải vuợt qua vùng biên hạt.
Nói chung, khí khử (reducing gases) làm tăng độ dẫn điện của vật liệu bán dẫn, trường hợp ngược lại được quan sát với khí oxy hoá (oxidizing gases). Oxygen tích điện âm được cho là gây nên hiện tượng này [29]. Oxygen tích điện âm gây ra sự trộn mức năng lượng hướng lên trên và vì thế độ dẫn giảm so với trạng thái không trộn lẫn. Phản ứng của các dạng oxygen với khí khử hay sự hấp phụ cạnh tranh và sự thay thế oxygen bị hấp phụ bởi các phân tử khác và có thể duy trì trạng thái trộn lẫn và kết quả là độ dẫn tăng.
Có hai dạng oxygen chủ yếu được phát hiện trên bề mặt của chất bán dẫn, chúng hình thành theo các phản ứng sau:
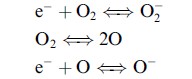
(1.13)
(1.14)
(1.15)



![Hình Thái Của Vật Liệu Zno Nano/micro Dạng Que Hình Thoi: A. Ảnh Sem; B. Ảnh Tem, C. Ảnh Hrtem (Ảnh Sead Nằm Góc Bên Phải) Của Micro Zno Hình Thoi [177]](https://tailieuthamkhao.com/uploads/2023/08/28/tong-hop-nano-kem-oxit-co-kiem-soat-hinh-thai-va-mot-so-ung-dung-4-1-120x90.gif)