Bảng 2.1: Phân vùng các tiểu khu tiêu thoát nước dọc theo sông Tô Lịch
Diện tích (km2) | L (km) | Dân số (1.000 người) | Tải lượng NTSH (1.000 m3) | |
HQV - CGI | 6,64 | 2 | 202,123 | 35,952 |
CGI - TDH | 2,27 | 2,2 | 60,473 | 10,756 |
TDH - NTS | 7,95 | 2,3 | 290,727 | 51,712 |
NTS - CKD | 0,66 | 1,3 | 178,16 | 3,169 |
CKD - CLU | 0,92 | 1,8 | 246,69 | 4,388 |
CLU - DAU | 0,76 | 1,5 | 205,57 | 3,657 |
DAU - DTL | 8,07 | 2,4 | 170,742 | 30,370 |
Tổng | 27,27 | 13,50 | 787,108 | 140,003 |
Có thể bạn quan tâm!
-
 Tổng Quan Về Ô Nhiễm Các Hợp Chất Hữu Cơ Trong Nước Sông
Tổng Quan Về Ô Nhiễm Các Hợp Chất Hữu Cơ Trong Nước Sông -
 Tổng Quan Xử Lý Ô Nhiễm Chất Hữu Cơ Bằng Phương Pháp Sục Khí
Tổng Quan Xử Lý Ô Nhiễm Chất Hữu Cơ Bằng Phương Pháp Sục Khí -
 Diễn Biến Giá Trị Cod Tầng Đáy Theo Thời Gian Của Hệ Sục Khí
Diễn Biến Giá Trị Cod Tầng Đáy Theo Thời Gian Của Hệ Sục Khí -
 Đánh Giá Chất Lượng Môi Trường Nước Sông Tô Lịch
Đánh Giá Chất Lượng Môi Trường Nước Sông Tô Lịch -
 Giá Trị Cod Của Các Mẫu Quan Trắc Sông Tô Lịch Trong Mùa Khô
Giá Trị Cod Của Các Mẫu Quan Trắc Sông Tô Lịch Trong Mùa Khô -
 Giá Trị Nh 4 + Của Các Mẫu Quan Trắc Sông Tô Lịch Vào Mùa Mưa
Giá Trị Nh 4 + Của Các Mẫu Quan Trắc Sông Tô Lịch Vào Mùa Mưa
Xem toàn bộ 109 trang tài liệu này.
TLV sông Tô Lịch được chia nhỏ thành 9 tiểu khu tiêu thoát và được xả vào 7 đoạn sông. Tổng lưu lượng nước thải xả vào sông Tô Lịch năm 2013 ước tính xấp xỉ 382.000 m3/ngày đêm, trong đó lượng NTSH là khoảng 140.000 m3/ngày đêm, NTSX là khoảng 236.000 m3/ngày đêm và NTBV là khoảng 6.000 m3/ngày đêm (bao gồm cả hướng thoát nước từ hạ lưu sông Lừ). Phân vùng và đặc điểm các tiểu khu tiêu thoát nước của TLV sông Tô Lịch theo các đoạn sông được mô tả trong bảng 2.1.
2.1.2 Phương pháp xử lý ô nhiễm chất hữu cơ bằng hợp chất chứa sắt
2.1.2.1 Cơ sở lý thuyết
Năm 1894 trong tạp chí Hội hóa học Mỹ đã công bố công trình nghiên cứu của J.H.Fenton, trong đó ông quan sát thấy phản ứng oxy hóa axit malic bằng
H2O2 đã được gia tăng mạnh khi có mặt các ion sắt. Sau đó, tổ hợp H2O2 và muối sắt Fe2+ được sử dụng làm tác nhân oxy hóa rất hiệu quả cho nhiều đối tượng rộng
rãi các chất hữu cơ và được mang tên “ tác nhân Fenton” (Fenton Reagent).
Hệ tác nhân Fenton đồng thể (Fenton cổ điển) là một hỗn hợp gồm các ion sắt hóa trị 2 và H2O2, chúng tác dụng với nhau sinh ra các gốc tự do *HO, còn Fe2+ bị oxi hóa thành Fe3+.
Fe2+ + H2O2 → Fe3+ + *HO + OH- (k = 63 l.mol-1.s-1) (1.1)
Phản ứng này được gọi là phản ứng Fenton vì Fenton là người đầu tiên đã mô tả quá trình này năm 1894.
Những ion Fe2+ mất đi sẽ được tái sinh lại nhờ Fe3+ tác dụng với H2O2 dư theo phản ứng:
Fe3+ + H2O2 → Fe2+ + H+ + *HO2. (k < 3.10-3 l.mol-1.s-1) (1.2)
Từ những phản ứng trên chứng tỏ tác dụng của sắt đóng vai trò là chất xúc tác. Quá trình khử Fe3+thành Fe2+ xảy ra rất chậm, hằng số tốc độ phản ứng rất nhỏ so với phản ứng (1.1), vì vậy sắt tồn tại sau phản ứng chủ yếu ở dạng Fe3+.
Gốc *HO sinh ra có khả năng phản ứng với Fe2+và H2O2, nhưng quan trọng nhất là là có khả năng phản ứng với nhiều chất hữu cơ tạo thành các gốc hữu cơ có khả năng phản ứng cao.
*HO + H2O2 → H2O + *HO2 (1.3)
*HO + Fe2+ → OH- + Fe3+ (1.4)
*HO + RH → H2O + *R (1.5)
Gốc *R có thể oxy hóa Fe2+, khử Fe3+ hoặc dimer hóa theo những phương trình phản ứng sau:
sau:
*R + Fe2+ → Fe3+ + RH (1.6)
*R + Fe3+ → Fe2+“sản phẩm” (1.7)
*R + *R → “sản phẩm” (1.8)
Gốc *HO2 có thể tác dụng với Fe2+, Fe3+ theo các phương trình phản ứng
*HO2 + Fe2+ → HO2- + Fe3+ (1.9)
*HO2 + Fe3+ → H+ + O2 + Fe3+ (1.10)
Phương trình phản ứng Fenton tổng cộng có dạng:
Fe2+ + H2O2 + RH → Fe3+ + H2O + CO2 (1.11)
Mặc dù tác nhân Fenton đã được biết hàng thế kỷ nay và thực tế đã chứng minh là một tác nhân oxi hóa rất mạnh do sự hình thành gốc hydroxyl *HO trong quá trình phản ứng, nhưng cơ chế của quá trình Fenton cho đến nay vẫn đang còn tranh cãi và tuyệt đại đa số các nhà nghiên cứu thừa nhận sự hình thành gốc hydroxyl *HO là nguyên nhân của khả năng oxy hóa cao của tác nhân Fenton.
2.1.2.2 Các yếu tố ảnh hưởng đến khả năng xử lý của phương pháp dùng hợp chất chứa sắt
Ảnh hưởng của nồng độ sắt
Nếu không có sắt, sẽ không có sự hình thành gốc hydroxyl. Chẳng hạn như, H2O2 được thêm vào nước thải có tính phenol (nồng độ phenol không giảm vì phản ứng phá hủy phenol cần xúc tác sắt). Khi nồng độ sắt tăng, sự loại trừ phenol tăng đến điểm mà tại đó, nếu có thêm sắt vào nữa thì hiệu quả cũng không tăng. Khoảng liều lượng tối ưu cho xúc tác sắt thay đổi tùy theo loại nước thải và là đặc trưng của phản ứng Fenton. Liều lượng sắt cũng có thể diễn tả dưới dạng liều lượng H2O2 . Khoảng điển hình là 1 phần Fe trên 1-10 phần H2O2.
Ảnh hưởng của dạng sắt
Đối với hầu hết các ứng dụng, muối Fe2+ hay Fe3+ đều có thể dùng xúc tác phản ứng. Phản ứng bắt đầu xúc tác nhanh chóng nếu H2O2 nhiều. Tuy nhiên, nếu lượng hệ chất Fenton thấp (dưới 10-25 mg/l H2O2), các nghiên cứu cho thấy sắt II được ưa chuộng hơn. Mặt khác, muối sắt chloride hay sulfat đều có thể được sử dụng. Cũng có khả năng tái tuần hoàn sắt sau phản ứng bằng cách tăng pH, tách riêng các bông sắt và tái axit hóa bùn sắt.
Ảnh hưởng của nồng độ H2O2
Các gốc hydroxyl oxy hóa chất hữu cơ mà không phân biệt. Ví dụ về một chuỗi phản ứng :
Chất nền -> A -> B -> C -> D -> CO2
Với A, B, C, D đại diện cho các chất trung gian bị oxy hóa. Mỗi sự chuyển đổi trong chuỗi này có tốc độ phản ứng riêng, và đôi khi chất trung gian tạo ra lại là một chất ô nhiễm không mong đợi. Những chất này đòi hỏi phải đủ lượng H2O2để
đẩy phản ứng lên trên điểm đó. Điều này có thể quan sát được khi tiền xử lý một nước thải hữu cơ phức tạp để giảm tính độc. Khi liều lượng H2O2 bắt đầu tăng dần, sự khử COD có thể xảy ra với ít hoặc không có sự thay đổi độc tính cho đến khi đạt một ngưỡng mà trên ngưỡng đó, việc thêm H2O2 sẽ làm giảm nhanh chóng độc tính nước thải.
Ảnh hưởng của nhiệt độ
Tốc độ phản ứng Fenton tăng cùng với sự gia tăng nhiệt độ, nhất là khi nhiệt độ nhỏ hơn 200C. Tuy nhiên, khi nhiệt độ lớn trên khoảng 40-500C, hiệu suất sử dụng của H2O2 giảm do sự phân hủy H2O2 tăng (tạo thành oxy và nước). Hầu hết
các ứng dụng của phản ứng Fenton xảy ra ở nhiệt độ 20-400C. Khi xử lý chất thải ô
nhiễm nặng, việc thêm H2O2 phải tiến hành tuần tự có kiểm soát để điều chỉnh sự gia tăng nhiệt độ (nhất là khi lượng H2O2 lớn hơn 10-20g/l). Điều hòa nhiệt độ quan trọng còn bởi lý do an toàn.
Ảnh hưởng của pH
pH tối ưu của phản ứng Fenton trong khoảng 3-6 Khi pH tăng cao trên 6, hiệu suất phản ứng sụt giảm do sự chuyển đổi của sắt từ ion sắt II thành dạng keo hydroxit sắt III. Dạng sắt III hydroxide xúc tác phân hủy H2O2 ¬thành oxy và nước mà không tạo nên gốc hydroxyl. Khi pH nhỏ hơn 3, hiệu suất phản ứng cũng sụt giảm nhưng đỡ hơn. Mặt khác, pH còn liên hệ với tiến triển của phản ứng. Ví dụ như pH nước thải ban đầu là 6. Trước tiên, pH giảm do thêm xúc tác FeSO4 . Sau đó, pH giảm nhiều hơn khi thêm H2O2, sự giảm cứ tiếp tục dần dần đến một mức nào đó (tùy vào nồng độ xúc tác). Người ta cho là sự giảm này do quá trình phân hủy các chất hữu cơ thành axit hữu cơ. Sự thay đổi pH thường xuyên được giám sát để đảm bảo rằng phản ứng đang phát triển theo đúng tiến độ. Nếu không xảy ra sự giảm pH, điều đó có thể có nghĩa là phản ứng bị cản trở. Những dòng nước thải đậm đặc (10g/l COD) cần oxy hóa nhiều bậc và điều chỉnh lại pH sau mỗi giai đoạn để ngăn ngừa pH thấp làm cản trở phản ứng.
Ảnh hưởng của thời gian phản ứng
Thời gian cần thiết để hoàn thành một phản ứng Fenton phụ thuộc vào nhiều yếu tố trên, đáng chú ý nhất là liều lượng xúc tác và mức ô nhiễm của nước thải. Đối với sự oxy hóa phenol đơn giản (<250 mg/l), thời gian phản ứng điển hình là 30-60 phút. Đối với các dòng thải phức tạp hoặc đậm đặc hơn, phản ứng có thể mất
vài giờ. Trong trường hợp này, thực hiện phản ứng theo từng bậc (nhiều bước), thêm cả vừa sắt và H2O2 sẽ hiệu quả hơn, an toàn hơn là cho tất cả hóa chất vào ngay từ đầu. Việc xác định điểm kết thúc phản ứng cũng khá khó khăn. Sự hiện diện của dư lượng H2O2 sẽ cản trở quá trình phân tích nước thải. Dư lượng H2O2 có thể bị khử bằng cách tăng pH đến 7-10, hoặc trung hòa với dung dịch bisulfite. Thường thì việc quan sát sự thay đổi màu cũng có thể đánh giá tiến trình phản ứng.
Ảnh hưởng của các anion vô cơ
Một số anion vô cơ thường gặp trong nước thải là những ion cacbonat (CO32), bicacbonat (HCO3-), Clorua (Cl-) sẽ tóm bắt các gốc hydroxyl *HO làm hao tổn số lượng gốc hydroxyl, giảm mất khả năng phản ứng oxi hóa,...Những chất tóm bắt này gọi chung là những chất tìm diệt gốc hydroxyl, những phản ứng săn lùng như sau:
*HO + CO32- → *CO3 + OH-
*HO + Cl → *Cl + OH-
Nói chung, các ion cacbonat (CO32-), bicacbonat (HCO3-), Clorua (Cl-
)thường có ảnh hưởng kìm hãm tốc độ phản ứng nhiều nhất. Để hạn chế các yếu tố ảnh hưởng trên cần chỉnh pH sang môi trường axit để chuyển cacbonat, bicacbonat
sang cacbonic axit (không phải chất tìm diệt gốc hydroxyl). Ngoài ra, một số anion vô cơ khác như các gốc sunfat (SO42-), Nitrat (NO3-), photphat (PO43-) cũng có thể tạo thành những phức chất không hoạt động với Fe3+ làm cho hiệu quả của quá trình
Fenton giảm đi nhưng ảnh hưởng này ở mức độ thấp.
2.1.3 Khả năng thay thế điện năng dùng cho hệ thống sục khí bằng pin mặt trời
Nếu tính năng lượng mặt trời trung bình trên 1 m2 khu vực Hà Nội trong một năm đạt gần 1442 kWh. Nếu sản xuất điện bằng pin mặt trời hiệu suất 13% thì thu được 187,5 kWh/m2.năm điện năng. Nếu sản xuất nhiệt bằng bộ thu NLMT hiệu suất 45% thì thu được gần 1,8 kWh/m2.ngày hay 649 kWh/m2.năm.
Với những thuận lợi đó, việc áp dụng giải pháp xử lý ô nhiễm CHC bằng hệ thống sục khí có sử dụng năng lượng tuy nhiên không đòi hỏi nguồn điện năng lớn, do vậy có thể cơ hội phát triển hệ thống sử dụng pin năng lượng mặt trời đem lại hiệu quả kinh tế và góp phần giảm ô nhiễm môi trường.
2.2 Phạm vi nghiên cứu
Luận văn giới hạn vùng nghiên cứu là toàn bộ sông Tô Lịch bao gồm đoạn từ Hoàng Quốc Việt đến Đập Thanh Liệt với chiều dài khoảng 13,5 km và đoạn rẽ nhánh từ Công ty TNHH Dịch vụ và Thương Mại Huy Văn qua trạm bơm Yên Sở với chiều dài khoảng 6,5 km. Như vậy tổng chiều dài của khu vực sông Tô Lịch giới hạn trong nghiên cứu của luận văn là khoảng 20 km.
Mẫu nước sử dụng cho hệ sục khí là mẫu lấy tại điểm quan trắc số 6 – Cầu Lủ. Sở dĩ lựa chọn vị trí lấy mẫu này làm đại diện cho nước sông Tô Lịch bởi đây là địa điểm nằm tại khu vực trung lưu của sông Tô Lịch, không quá gần về thượng nguồn hay hạ nguồn. Quá trình đánh giá khả năng xử lý chất hữu cơ của biện pháp sục khí được thực hiện gián tiếp thông qua việc theo dõi sự biến động của hai thông số chính là DO và COD trong nước thải theo thời gian sục khí.
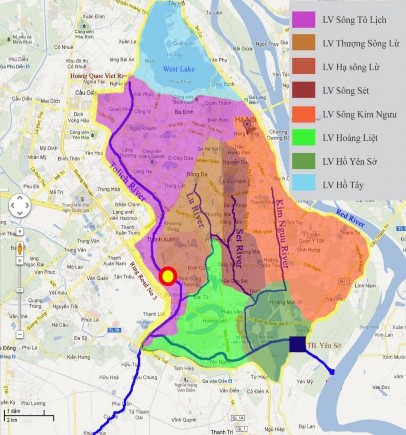
Hình 2.1 : Phạm vi nghiên cứu và điểm lấy mẫu tại Cầu Lủ
2.3 Phương pháp nghiên cứu
Bước 1
• Thu thập và tổng quan tài liệu
Bước 2
• Khảo sát hiện trường và tiến lựa chọn khu vực nghiên cứu
Bước 3
• Xác định vị trí quan trắc, tiến hành lấy mẫu bảo quản và phân tích
Bước 4
• Lựa chọn phương pháp xử lý COD phù hợp
Bước 5
• Tổng hợp và xử lý số liệu
Quá trình nghiên cứu và thực hiện luận văn có thể khái quát qua 5 bước
chính:
Bước 1: Thu thập, tham khảo và tổng quan các tài liệu liên quan đến vấn đề nghiên cứu.
Bước 2: Khảo sát hiện trường và tiến hành lựa chọn khu vực, phạm vi nghiên
cứu.
Bước 3: Xác định các vị trí lấy mẫu quan trắc, tiến hành lấy mẫu hiện trường, bảo quản mẫu và tiến hành phân tích trong phòng thí nghiệm.
Bước 4: So sánh hiệu quả xử lý COD bằng hệ thống sục khí và xử lý COD bằng hóa chất Fe.
Bước 5: Tổng hợp số liệu, kết quả phân tích; đánh giá, giải thích và đưa ra kết luận cùng với kiến nghị.
2.3.1 Phương pháp thừa kế có chọn lọc
Chọn lọc các nghiên cứu thực hiện trước đây có liên quan để kế thừa. Thu thập tài liệu về:
- Luận cứ khoa học, định lý, sách giáo khoa, luận văn, luận án, tài liệu chuyên ngành, sách chuyên khảo liên quan đến môi trường đặc biệt là tài nguyên nước.
- Các số liệu, tài liệu liên quan đến TPHN đã công bố được tham khảo từ các bài báo trong tạp chí khoa học, tập san, báo cáo chuyên đề khoa học ….
- Số liệu quan trắc được thu thập từ các: Sở tài nguyên môi trường Hà Nội, Trung tâm quan trắc môi trường Hà Nội, các công ty môi trường ….
2.3.2 Phương pháp lấy mẫu và bảo quản mẫu
Mẫu nước quan trắc, phân tích chỉ tiêu ô nhiễm được tiến hành lấy hiện trường tại 12 vị trí, cụ thể các vị trí được mô tả trên hình 2.2 và bảng 2.2.
Bảng 2.2: Vị trí lấy mẫu sông Tô Lịch
Ký hiệu | Vị trí lấy mẫu | Tọa độ | ||
1 | HQV | Hoàng Quốc Việt | 21o02’45.30” N | 105o48’18.97” E |
2 | CGY | Cầu Giấy | 21o01’48.81” N | 105o48’03.52” E |
3 | TDH | Trần Duy Hưng | 21o00’54.06” N | 105o48’15.21” E |
4 | NTS | Ngã Tư Sở | 21o00’06.04” N | 105o48’04.26” E |
5 | CKD | Cầu Khương Đình | 20o59’05.71” N | 105o48’50.54” E |
6 | CLU | Cầu Lủ | 20o58’49.02” N | 105o49’09.48” E |
7 | CDU | Cầu Dậu | 20o58’13.33” N | 105o49’29.25” E |
8 | TTL | Cuối Đập Thanh Liệt | 20o57’36.31” N | 105o48’45.71” E |
9 | STL | Sau Đập Thanh Liệt | 20o57’22.13” N | 105o48’34.38” E |
10 | NTL | Ngã ba trước Đập Thanh Liệt | 20o57’35.01” N | 105o48’48.03” E |
11 | CVD | Cầu Văn Điển | 20o57’04.51” N | 105o50’39.40” E |
12 | TYS | Trạm bơm Yên Sở | 20o57’26.53” N | 105o51’30.99” E |