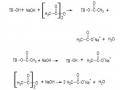e1. Quá trình oxi hóa tinh bột
Quá trình oxy hóa tinh bột có thể xảy ra theo một hoặc một số các phương trình sau:
- Oxy hoá nhóm andehit khử cuối mạch thành nhóm cacboxyl tạo các nhóm axit aldonic cuối mạch, thường được gọi là nhóm cuối axit D-gluconic.
CH2OH CH2OH
OH
O
HO OH C
H
[O]
Có thể bạn quan tâm!
-
 Nghiên cứu biến tính tinh bột bằng một số tác nhân hóa học và ứng dụng - 5
Nghiên cứu biến tính tinh bột bằng một số tác nhân hóa học và ứng dụng - 5 -
 Cơ Chế Thuỷ Phân Tinh Bột Bằng Axit
Cơ Chế Thuỷ Phân Tinh Bột Bằng Axit -
 Các Thành Phần Tá Dược Cho Thuốc Viên
Các Thành Phần Tá Dược Cho Thuốc Viên -
 Tình Hình Nghiên Cứu Biến Tính Tinh Bột Trong Nước
Tình Hình Nghiên Cứu Biến Tính Tinh Bột Trong Nước -
 Dụng Cụ, Thiết Bị Và Phương Pháp Nghiên Cứu
Dụng Cụ, Thiết Bị Và Phương Pháp Nghiên Cứu -
 Tiến Hành Oxi Hóa Tinh Bột Bằng Hypoclorit
Tiến Hành Oxi Hóa Tinh Bột Bằng Hypoclorit
Xem toàn bộ 190 trang tài liệu này.
OH
O

HO OH C
OH
(31)
- Oxy hoá nhóm metylol ở vị trí C6 thành nhóm cacboxyl
CH2OH
O
[O]
O
C OH O
O
C OH O
O
HO OH HO
O
OH HO
OH OH
(32)
- Oxy hoá nhóm hydroxyl bậc 2 c a tinh bột thành nhóm xeton. Phản ứng này thường diễn ra đối với nhóm –OH ở vị trí C tạo thành nhóm cacbonyl.
CH2OH
O
O
HO OH
[O]
CH2OH
O
O
O OH
(33)
- Oxy hoá các đơn vị 2,3-glycol thành các đơn vị diandehit và dicacboxylic.
CH2OH
O
O
[O]
CH2OH
O
O
[O]
CH2OH
O
O
HO OH C C
C C (34)
H OO H
HO OO OH
Quá trình oxy hoá tinh bột bằng natri hypoclorit diễn ra khá phức tạp do các phần tử phản ứng khác nhau có mặt trong dung dịch ở các pH khác nhau: trong môi trường kiềm ch yếu là OCl-, ở pH gần trung tính là HOCl không phân ly và một phần OCl-, ở pH 5,5 và 4, ch yếu là HOCl không phân ly. Phân tử
clo được tạo thành sẽ tăng lên khi tính axit c a môi trường tăng. Tinh bột bị oxy hoá ở các vị trí C-1, C-2, C- và C-6 c a gốc glucopyranozơ. ở các vị trí này nguyên tử oxy không bị ảnh hưởng trong khi đó hydro gắn với nguyên tử cacbon bị tách loại để chuyển hoá nhóm hydroxyl thành nhóm xeton hoặc cacboxylic. Quá trình chuyển hoá này làm tăng độ phân cực c a phân tử tinh bột. Phản ứng oxy hoá thường đi kèm với việc giải phóng axit dưới dạng sản phẩm phụ. Patel và cộng sự giả thiết rằng cơ chế phản ứng oxy hoá tinh bột liên quan đến sự chuyển dịch 2 proton: một proton được chuyển từ nhóm -OH, một proton khác được chuyển từ nhóm H-C. Môi trường phản ứng cũng đóng vai trò quan trọng trong quá trình oxy hoá tinh bột. Tốc độ oxy hoá giảm khi pH tăng từ 7 đến 10 và sau đó không đổi ít nhất là tới pH = 11,7. Mặc dù tốc độ oxy hoá cao nhất ở pH 7 thì tốc độ phân huỷ chất oxy hoá cũng cao nhất ở pH 7 khi nó chuyển thành clorat kém hoạt động. Tăng pH cũng làm tăng hàm lượng cacboxyl và làm giảm hàm lượng andehit [151]. Quá trình oxi hóa xảy ra trong các môi trường khác nhau đã được các tác giả đề xuất:
* Trong môi trường axit
Khi môi trường phản ứng có độ axit cao, hypoclorit bị chuyển hoá nhanh thành phân tử clo, phản ứng với nhóm hydroxyl c a tinh bột. Sự tạo thành các sản phẩm axit trong môi trường axit tương đối chậm và quá trình proton hoá các nhóm hydroxyl cũng có thể xảy ra.
![]()
H C OH + Cl Cl H C OCl + HCl
C
![]()
H O Cl C O + HCl (35)
* Trong môi trường kiềm
Trong môi trường kiềm, tốc độ tạo thành tinh bột kiềm chiếm ưu thế so với sự hình thành este tinh bột- hypohalogenua. Tinh bột kiềm phân ly để lại một điện tích âm trên phân tử tinh bột. Phản ứng giữa anion OCl- và tinh bột kiềm
tương đối chậm.
H C OH +
OCl-C O
+ H2O
+ Cl-
H C OH +
NaOH
H C ONa + H2O
H C ONa
H C O -
+ Na+
2H C O - +
OCl-
2C O
+ H2O + Cl- (36)
* Trong môi trường trung tính
Trong môi trường trung tính, cả hai chất tham gia phản ứng gần như là trung tính nhưng môi trường nước đ phân cực để thúc đẩy sự hình thành các sản phẩm phụ. Với việc tiêu hao các axit yếu không phân ly, nước và axit mạnh được tạo thành dưới dạng sản phẩm phụ.
H C OH + HOCl H C OCl + H2O
H C OCl C O
+ H + + Cl- (37)
Trong phản ứng oxy hoá, các nhóm hydroxyl c a glucozơ trước tiên bị oxy hoá thành nhóm cacbonyl và sau đó thành nhóm cacboxyl. Cả hàm lượng nhóm cacboxyl và cacbonyl c a tinh bột oxy hoá đều tăng khi tăng nồng độ clo hoạt động. Nhưng hàm lượng cacboxyl tăng mạnh hơn so với hàm lượng cabonyl do quá trình oxy hoá được tiến hành trong môi trường kiềm, pH ,5 và do hypoclorit thúc đẩy việc hình thành các nhóm cacboxyl so với việc tiến hành oxy hoá trong môi trường axit và trung tính [151-153].
e2. Tính chất của tinh bột oxy hoá
Về hạt c a tinh bột oxy hoá tương tự như tinh bột ban đầu, Chúng vẫn duy trì mức độ phân cực và vẫn cho phản ứng với iốt cho vết màu xanh như tinh bột chưa biến tính nhưng chúng trắng hơn tinh bột ban đầu. Đó là do phản ứng tẩy trắng c a natri hypoclorit lên các vết bẩn tinh bột. Quá trình xử lí bằng natri hypoclorit hoạt hoá quá trình hoà tan các vết bẩn làm cho chúng được rửa sạch khỏi tinh bột. Quá trình xử lý hypoclorit càng cao thì tinh bột càng trắng. Tuy nhiên, tinh bột này nhạy cảm với nhiệt hơn, nếu chúng được làm khô ở nhiệt độ cao chúng có khuynh hướng đổi màu [1 6]. Kết quả nghiên cứu cho thấy quá trình oxy hoá làm tăng kích thước hạt tinh bột lúa mì khoảng dưới 16%. Ngược lại, không có sự thay đổi đối với tinh bột ngô nếp. Một số tính chất khác c a tinh bột oxy hoá bằng natri hypoclorit là nhạy cảm với xanh metylen mà có khả năng thay đổi màu c a chất nhuộm. Các hạt tinh bột chưa biến tính không có sự hấp thụ chọn lọc này [1 8].
Một số tính chất hóa học c a tinh bột đã được khảo sát trong suốt quá trình oxy hoá bằng natri hypocloritcho thấy sự thay đổi tính chất lí hoá c a tinh bột trong suốt quá trình oxy hóa bằng natri hypoclorit dưới ảnh hưởng c a kiềm [152].
Sự tạo ra nhóm cacboxyl và cacbonyl, sự đứt liên kết glucorit xảy ra trong suốt quá trình oxy hoá phụ thuộc vào mức độ phản ứng. Nói chung khi mức độ phản ứng tăng lên thì trọng lượng phân tử giảm, độ nhớt thực giảm, số nhóm cacbonyl và nhóm cacboxyl tăng, tương quan giữa số nhóm cacbonyl và cacboxyl phụ thuộc vào điều kiện phản ứng [131]
Quá trình oxy hoá làm giảm độ nhớt hoặc làm tăng độ chảy c a hồ. Vì thế nó có thể bị hồ hóa trong nước ở nhiệt độ thấp hơn tinh bột chưa biến tính. Nói chung khi mức độ oxy hoá tăng thì độ lỏng tăng. Tuy nhiên, khi xử lí ở nồng độ natri hypoclorit thấp dưới điều kiện axit nhẹ hoặc kiềm loãng, hay quá trình oxy hoá bằng cách điện phân dung dịch kiềm natri clorua thì độ nhớt thực tăng lên [132,133].
Theo Kuakpetoon[136], tinh bột oxy hoá có nhiệt độ hồ hoá thấp hơn tinh bột ban đầu phụ thuộc vào mức độ oxy hoá, mức độ oxy hoá càng cao thì nhiệt
độ hồ hoá càng giảm. Sau khi hồ hoá trong nước nóng và lạnh, dạng hồ c a tinh bột oxy hoá không đặc lên và trở nên chắc về độ lỏng, giống như tinh bột chưa biến tính. Vì vậy tinh bột oxy hoá được sử dụng để ổn định dạng hồ trong một số sản phẩm.
Khả năng phân lớp và ổn định hồ tinh bột oxy hoá cao hơn so với tinh bột biến tính axit. Đó là thuộc tính ch yếu để phát hiện sự hiện diện c a nhóm cacboxyl trong phân tử tinh bột oxy hoá.
Kết quả nghiên cứu c a Felton và các cộng sự [61] cho thấy dạng hồ c a tinh bột oxy hoá bằng natri hypoclorit ứng dụng rất tốt trong sản xuất bánh kẹo gôm. Trong sản xuất kẹo gôm, tinh bột biến tính bằng natri hypoclorit được sử dụng rộng rãi hơn so với biến tính bằng axit vì khả năng ổn định c a nó cao hơn khi có mặt c a đường và cho vị hoàn thiện hơn so với tinh bột biến tính bằng axit [132, 135].
Tinh bột oxy hoá bởi natri hypoclorit có khuynh hướng tạo màng đồng nhất, ít bị co lại và ít bị gãy hơn so với những loại tinh bột biến tính bằng axit hoặc chưa biến tính. Dạng màng c a nó có khả năng hoà tan trong nước cao hơn so với tinh bột chưa biến tính hoặc biến tính bằng axit. Thuộc tính này là do nhóm ưa nước cacboxyl được hình thành trong quá trình oxy hoá [1 , 15 ].
e3. Hồ sợi
Hồ vải sợi được áp dụng để cung cấp thêm hoặc tăng cường các thuộc tính mong muốn c a vải sợi như chịu dầu, chống co, mềm,…Trong ngành công nghiệp dệt, tinh bột được sử dụng trong ba lĩnh vực chính: kích thước, hoàn thiện và in ấn. Khoảng 80% tinh bột được sử dụng trong dệt may được sử dụng trong kích thước sợi riêng lẻ c a sợi phải được định hình hoặc tạo hình thành một sợi dọc thông qua một giải pháp kích thước áo khoác các bề mặt c a sợi dọc xoắn. Các sợi bọc sau đó được đun nóng đến khô kích thước và một chùm sợi dọc đã sẵn sàng để dệt.
Tinh bột được sử dụng nhiều trong dệt sợi: cotton, tơ nhân tạo và các loại
sợi tổng hợp khác. Tinh bột oxy hóa sử dụng tổng công nghiệp dệt không nhiều như các loại tinh bột khác có thể do giá cả c a nó cao hơn nhưng bù lại điều này thì nó làm tăng hiệu suất và làm cho sản phẩm có tinh ưu việt hơn. Nó tạo cho sản phẩm dai, mềm dẻo và có thể chịu được cào xước c a khung cửi, thêm một lượng tinh bột oxy hóa bằng natri hypoclorit làm cho sản phẩm giữ màu lâu hơn. Tinh bột loại này đặc biệt phù hợp với tơ nhân tạo và tơ tổng hợp.
Trong hồ sợi chỉ được ph một lớp ph bảo vệ để chịu lực ma sát trong quá trình dệt. Như vậy sẽ giảm được dứt và trượt sợi nâng cao hiệu quả dệt và giảm các lỗi do sợi. Quá trình hồ yêu cầu vật liệu rẻ có thể phân tán dễ dàng để tạo ra dung dịch hồ không tạo bọt, không đông lại… độ nhớt ổn định để ph màng lên sợi màng dán bền, không dính, dẻo dai.
Quá trình in trên vải để tạo ra các hình mẫu có màu cần phải có chất làm đặc cho phẩm nhuộm. Kem màu được sản xuất cẩn thận để tạo ra dung dịch phân tán tốt chuyển hình sang vải và chất lượng màu tốt. Tuy nhiên cần chỉ ra rằng ứng dụng c a nhựa liên kết với chất màu không tan trong nước để làm thuốc nhuộm phân tán trong nước được sử dụng rộng rãi trong in có sử dụng chất làm đặc là tinh bột và gôm. Hệ thống mới này ch yếu dựa trên nhũ tương nước trong dầu đặc [156, 157].
1.4.3.7. Biến tính tinh bột bằng axit acrylic và cryla it
Quá trình đồng trùng hợp ghép giữa tinh bột và axit acrylic cùng các dẫn xuất c a nó là quá trình biến đổi những tính chất vật lý và hoá học c a polyme, đồng thời mở rộng khả năng sử dụng, tăng cường một số tính chất c a tinh bột sắn mà riêng tinh bột không đáp ứng được. Quá trình ghép này đã được thực hiện khá lâu trên thế giới, nhưng những năm gần đây các nước ở châu á và một số các nước khác mới tiến hành nghiên cứu và triển khai ứng dụng đã thu được một số thành tựu có nhiều triển vọng phát triển [55, 56, 155]
Khi trùng hợp một loại monome để tạo mạch nhánh đính vào một polyme có sẵn, quá trình được gọi là trùng hợp ghép, sản phẩm phản ứng được gọi là copolyme ghép. Phương pháp tổng hợp copolyme ghép có thể dựa trên phản ứng
chuyển mạch vào polyme, phản ứng khơi mào trùng hợp một loại monome nào đó bằng gốc đại phân tử c a monome khác hoặc dựa trên phản ứng c a các nhóm định chức trong thành phần c a các polyme khác. Khi tổng hợp copolyme ghép thường xảy ra ít nhất 2 quá trình:
- Quá trình 1 là sự trùng hợp ghép monome vào polyme tạo thành copolyme ghép
- Quá trình 2 là sự tự trùng hợp c a monome tạo thành homopolyme (polyme tự trùng hợp).
Một số phương pháp ghép đã được phát triển và được chia thành nhóm: trùng hợp ghép gốc tự do; trùng hợp ghép ion; ngưng tụ và trùng hợp mở vòng. Tuy nhiên phương pháp ngưng tụ chỉ thành công trong một số trường hợp. Phương pháp trùng hợp ghép gốc tự do được quan tâm nhiều nhất do nó có tính thực tiễn [59].
a. Cơ sở quá trình biến tính
Biến tính vinyl monome lên tinh bột thực chất là quá trình tạo nhánh trên phân tử tinh bột, chuyển phân tử tinh bột từ dạng mạch thẳng sang dạng mạch nhánh. Phân tử tinh bột có nhánh gọi là copolyme ghép, trong đó các nhánh được tạo nên từ các monome. Để thu được copolyme ghép, ta cần tạo trên mạch tinh bột các gốc tự do, đó là các gốc đại phân tử, khơi mào cho phản ứng trùng hợp hay đồng trùng hợp ghép. Trùng hợp ghép gốc tự do được thực hiện dựa trên cơ sở phản ứng chuyển mạch lên polyme, có thể là phản ứng chuyển mạch c a các gốc tự do lên monome, dung môi, polyme hay có thể lên các tạp chất. Nếu các đoạn polyme tham gia phản ứng chuyển mạch với các đoạn khác thì sẽ tạo thành copolyme ghép (graft copolymer). Quá trình chuyển mạch được thực hiện bởi sự tương tác c a gốc tự do lên các trung tâm hoạt động trên polyme (như hydro hoạt động, halogen) và tạo ra gốc mới [60, 94].
Quá trình đồng trùng hợp ghép tinh bột dùng tác nhân khơi mào tạo gốc tự do là kali persunfat (K2S2O8). Các tác giả đã đưa ra cơ chế đề xuất như sau: [ ,100].
Khơi mào:
+ Ion pesunfat dưới tác dụng c a nhiệt độ trong dung dịch nước bị phân huỷ và tạo thành gốc ion sunfat:
2- -
S2O8 2 SO4 (38)
+ Gốc ion này sau đó phản ứng với H2O để sinh ra gốc tự do hydroxy: SO4- + H2O HSO4- + HO(39)
+ Các gốc tự do sunfat và hydroxy tấn công vào tinh bột và lấy H trên tinh bột. Như vậy tạo ra các gốc tự do trên tinh bột và có khả năng ghép với vinyl monome:
TB - H + SO4- TB+ HSO4-
TB - H + OH TB+ H2O (40)
+ Và sau đó các gốc tự do mới sinh ra trên tinh bột này phản ứng với monome:
TB CH2 CH2
X
TB CH2 CH
X
(41)
Ngoài ra còn có phản ứng trùng hợp tạo homopolyme và phản ứng này cũng được khơi mào bởi các gốc tự do:
CH2 CH2 OH
X
Phát triển mạch:
HO CH2 HC
X
(42)
TB CH2 CH
X
nCH2 CH X
TB (CH2 CH)n CH2 HC
![]()
X X
HO CH2 CH
X
nCH2
CH HO X
CH2 CH
X
(CH2
CH)n 1
X
CH2 CH
X
(43)
Ngắt mạch và chuyển mạch: