0 và m = 0 có dạng hình cầu. Các obitan p ứng với l = 1 có dạng hình quả tạ đôi hay hình số tám nổi, ba giá trị m = -1, 0, 1 ứng với ba sự định hướng khác nhau của ba obitan p xung quanh hạt nhân. Các obitan d ( l = 2) là hình khối bốn cánh tiếp xúc với nhau ở hạt nhân. Có năm obitan ứng với năm giá trị của m là -2, -1, 0, 1, 2. (hình 1.3).
e. Sự phân bố các electron trong nguyên tử ở trạng thái cơ bản
Nguyên lý loại trừ (nguyên lí Pauli)
Trong một nguyên tử không thể tồn tại hai electron có cùng giá trị của bốn số lượng tử n, l , m và ms.
Theo nguyên lý này, trong một nguyên tử nếu hai electron đã có ba số lượng tử
n, l, m giống nhau thì số lượng tử thứ tư ms phải có giá trị khác nhau.
Từ nguyên lý này đã xác định được:
Số electron tối đa trong một ô lượng tử là 2, người ta kí hiệu mỗi electron bằng một mũi tên trong một ô lượng tử ![]()
Số electron tối đa trong một phân lớp là 2(2 l +1); Số electron tối đa trong một lớp là 2n2.
Bảng 1.2. Số electron tối đa trên một số lớp và phân lớp
K | L | M | N | |||||||
1 | 2 | 3 | 4 | |||||||
Phân lớp l | 0 | 0 | 1 | 0 | 1 2 | 0 1 | 2 d | 3 | ||
kí hiệu phân lớp | s | S | p 6 | s 2 | p | d | s 2 | p 6 | f | |
Số e tối đa ở phân lớp l | 2 | 2 | 6 10 | 10 14 | ||||||
Số e tối đa ở lớp n | 2 | 8 | 18 | 32 | ||||||
Có thể bạn quan tâm!
-
 Hóa học đại cương - 1
Hóa học đại cương - 1 -
 Hóa học đại cương - 2
Hóa học đại cương - 2 -
 Sự Biến Đổi Tuần Hoàn Cấu Trúc Vỏ Electron Của Nguyên Tử Các Nguyên Tố
Sự Biến Đổi Tuần Hoàn Cấu Trúc Vỏ Electron Của Nguyên Tử Các Nguyên Tố -
 Hai Nguyên Tố A Và B Ở Hai Phân Nhóm Chính Liên Tiếp Nhau Trong Hệ Thống Tuần Hoàn. Ở Trạng Thái Đơn Chất A Và B Không Phản Ứng Với Nhau. Tổng Số Proton
Hai Nguyên Tố A Và B Ở Hai Phân Nhóm Chính Liên Tiếp Nhau Trong Hệ Thống Tuần Hoàn. Ở Trạng Thái Đơn Chất A Và B Không Phản Ứng Với Nhau. Tổng Số Proton -
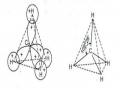
 A. Sự Xen Phủ Các Obitan 1S Trong Phân Tử H 2
A. Sự Xen Phủ Các Obitan 1S Trong Phân Tử H 2
Xem toàn bộ 237 trang tài liệu này.
Nguyên lý vững bền: Trong nguyên tử, các electron ở trạng thái cơ bản sẽ được xếp tuần tự vào các obitan ứng với các phân mức năng lượng từ thấp đến cao. Thực nghiệm cho biết thứ tự đó như sau:
1s < 2s < 2p <3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f <...
Ví dụ: Nguyên tử Mn có số thứ tự là 25 trong bảng hệ thống tuần hoàn nên có 25e (Z = 25). Việc sắp xếp các electron vào nguyên tử Mangan như sau: 1s2 2s2 2p63s2 3p63d5 4s2. Như vậy số electron ở các lớp như sau: Lớp K (2e), lớp L (8e), lớp M (7e), lớp N (2e). Đó là cấu hình electron của nguyên tử dưới dạng chữ.
Quy tắc Hun: Trong một phân lớp chưa đủ số electron tối đa, các electron có xu hướng phân bố đều vào các obitan (các ô lượng tử) sao cho có số electron độc thân với các giá trị số lượng tử spin cùng dấu lớn nhất.
Ví dụ: Nguyên tử C (Z = 6), N (Z = 7) ở trạng thái cơ bản có cấu hình electron như sau:
C:
N:
Một electron chiếm một AO (ô lượng tử) được gọi là electron độc thân.
Cấu hình electron nguyên tử được viết dưới dạng ô lượng tử như trên gọi là cấu hình electron nguyên tử dưới dạng ô lượng tử.
1.3. Bảng hệ thống tuần hoàn các nguyên tố hoá học
1.3.1. Cấu tạo của bảng tuần hoàn (bảng 1.3)

a. Chu kì
Bảng hệ thống tuần hoàn gồm bảy chu kì.
Các nguyên tử của các nguyên tố trong cùng một chu kì đều có số lớp electron bằng nhau và bằng số thứ tự chu kì chứa chúng.
Ví dụ: Các nguyên tử của các nguyên tố chu kì 2 đều có hai lớp K và L.
Bảng 1.4. Cấu hình electron của các nguyên tố
Z | Nguyên tố | Cấu hình electron | |
1 | 1 | H | 1s1 |
2 | He | 1s2 | |
2 | 3 | Li | [He] 2s1 |
4 | Be | [He] 2s2 | |
5 | B | [He] 2s2 2p1 | |
6 | C | [He] 2s2 2p2 | |
7 | N | [He] 2s2 2p3 | |
8 | O | [He] 2s2 2p4 | |
9 | F | [He] 2s2 2p5 | |
10 | Ne | [He] 2s2 2p6 | |
3 | 11 | Na | [Ne] 3s1 |
12 | Mg | [Ne] 3s2 | |
13 | Al | [Ne] 3s2 3p1 | |
14 | Si | [Ne] 3s2 3p2 | |
15 | P | [Ne] 3s2 3p3 |
16 | S | [Ne] 3s2 3p4 | |
17 | Cl | [Ne] 3s2 3p5 | |
18 | Ar | [Ne] 3s2 3p6 | |
4 | 19 | K | [Ar] 4s1 |
20 | Ca | [Ar] 4s2 | |
21 | Sc | [Ar] 4s2 3d1 | |
22 | Ti | [Ar] 4s2 3d2 | |
23 | V | [Ar] 4s2 3d3 | |
24 | Cr | [Ar] 4s2 3d5 | |
25 | Mn | [Ar] 4s1 3d5 | |
26 | Fe | [Ar] 4s2 3d6 | |
27 | Co | [Ar] 4s2 3d7 | |
28 | Ni | [Ar] 4s2 3d8 | |
29 | Cu | [Ar] 4s1 3d10 | |
30 | Zn | [Ar] 4s2 3d10 | |
31 | Ga | [Ar] 4s2 3d10 4p1 | |
32 | Ge | [Ar] 4s2 3d10 4p2 | |
33 | As | [Ar] 4s2 3d104p3 | |
34 | Se | [Ar] 4s2 3d104p4 | |
35 | Br | [Ar] 4s2 3d104p5 | |
36 | Kr | [Ar] 4s2 3d104p6 |
37 | Rb | [Kr] 5s1 | |
38 | Sr | [Kr] 5s2 | |
39 | Y | [Kr] 5s2 4d1 | |
40 | Zr | [Kr] 5s2 4d2 | |
41 | Nb | [Kr] 5s2 4d3 | |
42 | Mo | [Kr] 5s1 4d5 | |
43 | Tc | [Kr] 5s2 4d5 | |
44 | Ru | [Kr] 5s1 4d7 | |
45 | Rh | [Kr] 5s1 4d8 | |
46 | Pb | [Kr] 5so 4d10 | |
47 | Ag | [Kr] 5s1 4d10 | |
48 | Cd | [Kr] 5s2 4d10 | |
49 | In | [Kr] 5s2 4d10 5p1 | |
50 | Sn | [Kr] 5s2 4d10 5p2 | |
51 | Sb | [Kr] 5s2 4d10 5p3 | |
52 | Te | [Kr] 5s2 4d10 5p4 | |
53 | I | [Kr] 5s2 4d10 5p5 | |
54 | Xe | [Kr] 5s2 4d10 5p6 | |
6 | 55 | Cs | [Xe] 6s1 |
56 | Ba | [Xe] 6s2 | |
57 | La | [Xe] 6s2 5d1 |
58 | Ce | [Xe] 6s2 4f1 5d1 |
59 | Pr | [Xe] 6s2 4f3 5d0 |
60 | Nd | [Xe] 6s2 4f4 5d0 |
61 | Pm | [Xe] 6s2 4f5 5d0 |
62 | Sm | [Xe] 6s2 4f6 5d0 |
63 | Eu | [Xe] 6s2 4f7 5d0 |
64 | Gd | [Xe] 6s2 4f7 5d1 |
65 | Td | [Xe] 6s2 4f9 5d0 |
66 | Dy | [Xe] 6s2 4f10 5d0 |
67 | Ho | [Xe] 6s2 4f11 5d0 |
68 | Er | [Xe] 6s2 4f12 5d0 |
69 | Tm | [Xe] 6s2 4f13 5d0 |
70 | Yb | [Xe] 6s2 4f14 5d0 |
71 | Lu | [Xe] 6s2 4f14 5d1 |
72 | Hf | [Xe] 6s2 4f14 5d2 |
73 | Ta | [Xe] 6s2 4f14 5d3 |
74 | W | [Xe] 6s2 4f14 5d4 |
75 | Re | [Xe] 6s2 4f14 5d5 |
76 | Os | [Xe] 6s2 4f14 5d6 |
77 | Ir | [Xe] 6s2 4f14 5d7 |
78 | Pt | [Xe] 6s1 4f14 5d9 |
79 | Au | [Xe] 6s1 4f14 5d10 | |
80 | Hg | [Xe] 6s2 4f14 5d10 | |
81 | Ti | [Xe] 6s2 4f14 5d10 6p1 | |
82 | Pb | [Xe] 6s2 4f14 5d10 6p2 | |
83 | Bi | [Xe] 6s2 4f14 5d10 6p3 | |
84 | Po | [Xe] 6s2 4f14 5d10 6p4 | |
85 | At | [Xe] 6s2 4f14 5d10 6p5 | |
86 | Rn | [Xe] 6s2 4f14 5d10 6p6 | |
7 | 87 | Fr | [Rn] 7s1 |
88 | Ra | [Rn] 7s2 | |
89 | Ac | [Rn] 7s2 6d1 | |
90 | Th | [Rn] 7s2 5f0 6d2 | |
91 | Pa | [Rn] 7s2 5f2 6d1 | |
92 | U | [Rn] 7s2 5f3 6d1 | |
93 | Np | [Rn] 7s2 5f4 6d1 | |
94 | Pu | [Rn] 7s2 5f6 6d0 | |
95 | Am | [Rn] 7s2 5f7 6d0 | |
96 | Cm | [Rn] 7s2 5f7 6d1 | |
97 | Br | [Rn] 7s2 5f9 6d0 | |
98 | Cf | [Rn] 7s2 5f10 6d0 | |
99 | Es | [Rn] 7s2 5f11 6d0 |
100 | Fm | [Rn] 7s2 5f12 6d0 |
101 | Md | [Rn] 7s2 5f13 6d0 |
102 | No | [Rn] 7s2 5f14 6d0 |
103 | Lr | [Rn] 7s2 5f14 6d1 |
104 | Km | [Rn] 7s2 5f14 6d2 |
105 | Ns | [Rn] 7s2 5f14 6d3 |