1.3.3. Hóa trị
Với UTPKTBN, mục đích của hóa trị là điều trị khi khối u đã lan tràn ra toàn thân từ vị trí nguyên phát của bệnh. Hóa trị bao gồm hóa trị phối hợp với phẫu thuật và xạ trị trong điều trị triệt căn ung thư phổi giai đoạn IB, IIA, IIIB, IIIA, hóa trị tân bổ trợ trong giai đoạn IIIA, kết hợp với xạ trị lồng ngực trong giai đoạn IIIB và hóa chất triệu chứng trong giai đoạn IV. Với UTPKTBN giai đoạn tiến triển, hóa trị giúp kéo dài thêm thời gian sống và chất lượng cuộc sống[22].
1.3.4. Điều trị đích
1.3.4.1. Tổng quan điều trị đích trong điều trị ung thư phổi không tế bào nhỏ
Trong những năm gần đây, đã có sự thay đổi đáng kể trong quản lý và điều trị UTPKTBN cùng với sự phát triển của sinh học phân tử và việc phát hiện các gen đột biến liên quan tới ung thư. Bên cạnh việc điều trị hóa trị cho những bệnh nhân với những tổn thương đã không còn khu trú mà không biết rõ về đột biến đích, liệu pháp điều trị nhắm đích đang được chứng minh là cải thiện đáng kể kết quả và chất lượng cuộc sống của bệnh nhân.
1.3.4.2. Điều trị UTPKTBN có đột biến EGFR nhạy cảm TKIs
a. Thụ thể yếu tố phát triển biểu bì (EGFR)
Thụ thể yếu tố tăng trưởng biểu bì (Epidermal Growth Factor Receptor
- EGFR) là một chuỗi đơn polypeptide bao gồm 1186 aminoacid, trong lượng phân tử 170 kDaltons (kDa), được bộc lộ trên bề mặt của hầu hết các tế bào bình thường[33]. EGFR bao gồm bốn thành viên: EGFR (HER1), HER2/neu, HER3 và HER4. Thụ thể này đã được chứng minh là có vai trò quan trọng trong việc điều hòa các quá trình sinh trưởng, phát triển, trao đổi chất và sinh lý của tế bào[18].
Protein EGFR mang hoạt tính tyrosine kinase, là khởi nguồn của con đường tín hiệu tyrosine kinase trong tế bào. Phân tử EGFR gồm một vùng gắn kết các phối tử nằm ngoài màng tế bào, một vùng xuyên màng đặc hiệu và một vùng nội bào. Phần ngoài màng của EGFR có trọng lượng khoảng 100 kDa có hai vùng giàu cystein là nơi để gắn kết các phối tử của EGFR. Vùng
xuyên màng trọng lượng nhỏ 3 kDa, tập trung tại vùng phân cực phospholipid màng. Phần trong tế bào trọng lượng khoảng 60 kDa là protein kinase với đuôi tận cùng carboxyl là nơi xảy ra phản ứng tự phosphoryl hóa của EGFR.
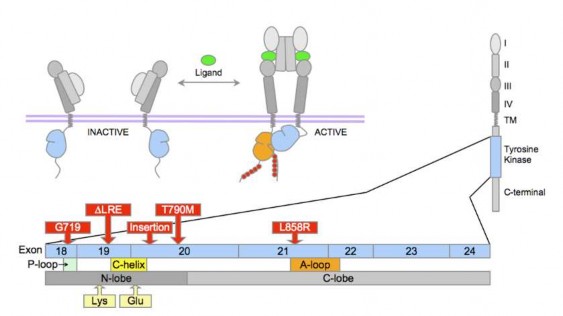
Hình 1. 5: Cấu trúc thụ thể yếu tố phát triển biểu mô (EGFR) và sự hoạt hóa của EGFR[18].
Hoạt động của EGFR kích thích nhiều con đường nội bào phức tạp, được điều hòa chặt chẽ bởi sự hiện diện của phối tử đặc hiệu. Ngay sau khi liên kết với phối tử, vùng nội bào của EGFR sẽ tự phosphoryl hóa và dẫn đến việc kích thích các con đường nội bào tiếp theo, chẳng hạn như các con đường sau: RAS/ RAF/ MEK/ MAPK/ ERK, phosphatidylinositol 3-kinase (PI3K) và Akt, protein kinase C (PKC), Src, và các con đường JAK/ STAT[12]. Các dòng tín hiệu này dẫn đến sự biểu hiện gen, tăng sinh hình thành mạch, ức chế quá trình chết theo trương trình, khả năng di căn và kết dính[14].
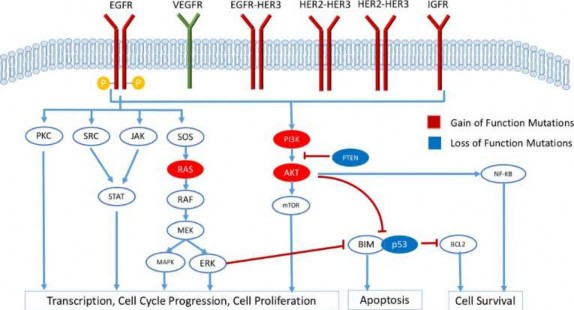
Hình 1. 6: Các con đường truyền tín hiệu nội bào khởi nguồn từ EGFR[35].
b. Đột biến gen EGFR
Các đột biến gen EGFR (Hình 1.3) được tìm thấy trong bốn exon 18- 21, mã hóa vùng tyrosine kinase, khiến cho protein EGFR luôn trong trạng thái hoạt hóa không phụ thuộc vào phối tử, làm tăng sự nhạy cảm của khối u hoặc giúp kháng lại các EGFR TKIs. Những đột biến này được chia làm ba nhóm, trong đó, các đột biến làm tăng tính nhạy cảm của khối u với EGFR TKIs chủ yếu thuộc hai nhóm I và II.
Các đột biến EGFR phổ biến nhất là đột biến mất đoạn ở exon 19 (Del19) và đột biến điểm L858R ở exon 21, cùng chiếm 85–90% tổng số đột biến EGFR[27]. Nhiều đột biến không phổ biến trong các exon 18–21 của EGFR, bao gồm S786I, G719X và L861Q, cũng đã được xác định trong UTPKTBN[24].
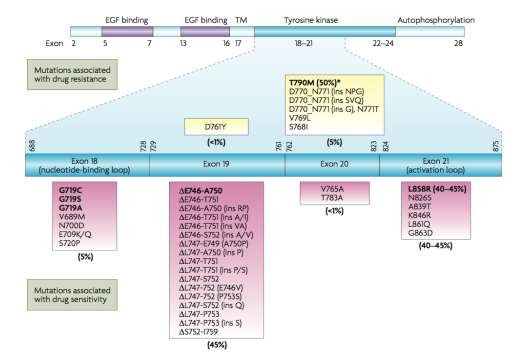
Hình 1. 7: Các dạng đột biến EGFR[31]
Đột biến EGFR được tìm thấy ở một số lượng đáng kể bệnh nhân UTKTBN. Một nghiên cứu thực hiện bởi Hiệp hội Y khoa Massachusetts, đột biến EGFR được tìm thấy ở 16,6% bệnh nhân UTPKTBN (350 trong tổng số 2105 bệnh nhân) và thường gặp ở phụ nữ (69,7%), bệnh nhân không hút thuốc (66,6%) và ở những trường hợp UTBMT (80,9%)[29]. Tại Việt Nam, 40% đột biến EGFR được phát hiện trên các bệnh nhân UTPKTBN với tần suất đột biến ưu thế hơn ở nữ (48,9% so với 35% ở nam giới) và không có sự khác biệt giữa các dạng mô bệnh học[34].
c. Các chất ức chế tyrosine kinase của EGFR
- Các kháng thể đơn dòng kháng EGFR
Các kháng thể đơn dòng có vai trò ngăn chặn sự gắn kết của các phối tử nội sinh với phần ngoại bào của EGFR, gồm có cetuximab và pantuximab.
- Các chất EGFR TKIs dạng phân tử nhỏ
TKIs dạng phân tử nhỏ là các phân tử tổng hợp có trọng lượng phân tử thấp, có nguồn gốc từ nhóm quinazoline, có vai trò ngăn chặn vị trí gắn kết magnesium-ATP của vùng tyrosine kinase nội bào (làm giảm ái lực của EGFR
và phối tử), từ đó ngăn chặn sự tự phosphoryl hóa của EGFR và các con đường tín hiệu xuôi dòng[20].
Các thế hệ thuốc TKIs hiện nay:
+ Thế hệ 1 (Erlotinib, Gefitinib): chất ức chế thuận nghịch EGFR.
+Thế hệ 2 (Afatinib, Dacotinib): chất ức chế không thuận nghịch EGFR, HER-2, HER-4.
+ Thế hệ 3 (Osimertinib): có hiệu quả trên đột biến kháng thuốc T790M.
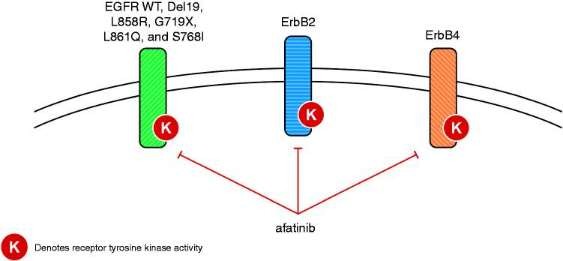
Hình 1. 8: Sự ức chế các thành viên gia đình ErbB, gồm kiểu hoang dã và đột biến EGFR bởi Afatinib
1.4. Một số nghiên cứu trên thế giới và trong nước
Trên thế giới, điều trị UTPKTBN bằng Afatinib đã có nhiều nghiên cứu. Passaro A. và cộng sự (2021) phân tích gộp trên 1108 bệnh nhân UTPKTBN giai đoạn di căn và tiến xa mang đột biến EGFR được điều trị bằng Afatinib ghi nhận kết quả đáp ứng khối u theo mRECIST ở mức cao, với tỉ lệ đáp ứng hoàn toàn, đáp ứng một phần, bệnh ổn định và bệnh tiến triển lần lượt là 3,6%; 51,4%; 33,2% và 11,8%[26]. Ho GF và cộng sự (2019) nghiên cứu trên 85 bệnh nhân UTPKTBN điều trị bằng Afatinib cho thấy chỉ một phần mười số bệnh nhân gặp phải các phản ứng phụ nghiêm trọng, tỉ lệ kiểm soát bệnh là 95,3% và thời gian sống thêm không tiến triển trung bình là 14,2 tháng[15].
Tại Việt Nam, nghiên cứu trên lĩnh vực này ít hơn, có thể kể đến nghiên cứu của Nguyễn Thị Thái Hòa và cộng sự (2019) trên 30 bệnh nhân
UTPKTBN giai đoạn IIIC, IV, có đột biến EGFR, điều trị tại Bệnh viện K Trung ương. Nghiên cứu cho thấy Afatinib cho tỷ lệ đáp ứng cao ở cả đột biến thường gặp và đột biến hiếm với 52,2% bệnh nhân đáp ứng một phần và 39,1% bệnh ổn định; các tác dụng không mong muốn cũng được kiểm soát tốt, thường gặp nhất là tiêu chảy (36,6%) và ban da dạng mụn (33,3%), không gặp độ 3, 4[4].
Nhìn chung, Afatinib đem lại hiệu quả điều trị cao cho nhóm bệnh nhân UTPKTBN có đột biến EGFR với ít tác dụng phụ, tỉ lệ kiểm soát bệnh cao và kéo dài thêm thời gian sống cho bệnh nhân. Một vài năm trở lại đây, Bệnh viện Bạch Mai đã áp dụng thuốc này, tuy nhiên số lượng nghiên cứu còn hạn chế, đó là lý do chúng tôi tiến hành nghiên cứu này.
CHƯƠNG 2: ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Đối tượng nghiên cứu: bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn IIIb-IV được điều trị bằng Afatinib tại Trung tâm Y học hạt nhân và Ung bướu – Bệnh viện Bạch Mai từ tháng 1/2020 đến tháng 12/2021.
2.1.1. Tiêu chuẩn lựa chọn
- Bệnh nhân được chẩn đoán UTPKTBN, giai đoạn IIIB-IV (AJCC 2018).
- Có đột biến EGFR loại nhạy cảm với Afatinib.
- Được điều trị bằng Afatinib ít nhất 03 tháng tính đến thời điểm nghiên cứu.
- Tuổi ≥ 18.
2.1.2. Tiêu chuẩn loại trừ
Các đối tượng không có lưu lại hồ sơ bệnh án hoặc lưu lại không đầy đủ thông tin hoặc các đối tượng không đồng ý tham gia nghiên cứu.
2.2. Thời gian và địa điểm nghiên cứu
- Thời gian: tháng 1/2020 đến tháng 12/2021.
- Địa điểm nghiên cứu: Trung tâm Y học hạt nhân và Ung bướu – Bệnh viện Bạch Mai.
2.3. Phương pháp nghiên cứu
2.3.1. Thiết kế nghiên cứu
Dùng phương pháp nghiên cứu mô tả, hồi cứu.
2.3.2. Cỡ mẫu nghiên cứu
Chọn mẫu thuận tiện: Chúng tôi chọn 39 bệnh nhân điều trị ngoại trú từ tháng 1 năm 2020 đến tháng 12 năm 2021 thỏa mãn các tiêu chuẩn chọn bệnh nhân và tiêu chuẩn loại trừ ở trên được chọn lần lượt vào nghiên cứu.
2.3.3. Quy trình nghiên cứu
Đánh giá trước điều trị
Bệnh nhân UTPKTBN giai đoạn IIIB-IV được đánh giá trước điều trị như sau:
- Các triệu chứng, hội chứng cận u.
- Chụp CLVT lồng ngực đánh giá kích thước, vị trí, mức độ xâm lấn của khối u, xếp giai đoạn T; kích thước, vị trí hạch, đánh giá N.
- Siêu âm hoặc chụp cắt lớp ổ bụng, xạ hình xương toàn thân, chụp CT hoặc MRI sọ não: đánh giá mức độ di căn xa.
- Marker ung thư: CEA, Cyfra 21-1.
- Kết quả mô bệnh học, kết quả xét nghiệm đột biến gen EGFR.
Đánh giá sau điều trị
Các bệnh nhân được đánh giá lại sau 03 tháng điều trị như sau:
- Các triệu chứng, hội chứng cận u.
- Các tác dụng không mong muốn của Afatinib.
- Chụp CLVT lồng ngực đánh giá kích thước khối u.
- Marker ung thư: CEA, Cyfra 21-1.
2.3.4. Kỹ thuật thu thập thông tin
- Thu thập thông tin bằng bệnh án nghiên cứu được xây dựng sẵn. Thông tin cần thu thập được lấy từ hồi cứu các bệnh án có sẵn hoặc được lưu trữ trong kho hồ sơ bệnh án ngoại trú của Trung tâm Ung bướu – Bệnh viện Bạch Mai hoặc phỏng vấn trực tiếp người bệnh.
- Quá trình thu thập thông tin:
+ Tiếp nhận các bệnh nhân có đăng ký khám
+ Các bác sĩ tại khoa khám và thu thập thông tin vào bệnh án điện tử
+ Nhập liệu từ bệnh án và phân tích số liệu trên bộ công cụ IBM
SPSS.
2.4. Các biến số nghiên cứu
Bảng 2. 3: Các biến số nghiên cứu
Định nghĩa | |
Tuổi | Tuổi của bệnh nhân ở thời điểm phát hiện UTP. |
Có thể bạn quan tâm!
-
 Đánh giá đặc điểm lâm sàng, cận lâm sàng bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn IIIB-IV được điều trị bằng Afatinib - 1
Đánh giá đặc điểm lâm sàng, cận lâm sàng bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn IIIB-IV được điều trị bằng Afatinib - 1 -
 Đánh giá đặc điểm lâm sàng, cận lâm sàng bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn IIIB-IV được điều trị bằng Afatinib - 2
Đánh giá đặc điểm lâm sàng, cận lâm sàng bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn IIIB-IV được điều trị bằng Afatinib - 2 -
 Tiêu Chuẩn Đánh Giá Đáp Ứng Điều Trị Của Khối U
Tiêu Chuẩn Đánh Giá Đáp Ứng Điều Trị Của Khối U -
 Đặc Điểm Cận Lâm Sàng Bệnh Nhân Ung Thư Phổi Không Tế Bào Nhỏ Giai Đoạn Iiib-Iv Được Điều Trị Bằng Afatinib
Đặc Điểm Cận Lâm Sàng Bệnh Nhân Ung Thư Phổi Không Tế Bào Nhỏ Giai Đoạn Iiib-Iv Được Điều Trị Bằng Afatinib -
 Đặc Điểm Cận Lâm Sàng Của Bệnh Nhân Utpktbn Giai Đoạn Iiib-Iv Được Điều Trị Bằng Afatinib
Đặc Điểm Cận Lâm Sàng Của Bệnh Nhân Utpktbn Giai Đoạn Iiib-Iv Được Điều Trị Bằng Afatinib
Xem toàn bộ 72 trang tài liệu này.
Nam hay nữ. | |
Hút thuốc lá | Không hút, từng hút thuốc, hiện đang hút thuốc. |
Triệu chứng toàn thân | Sụt cân, mệt mỏi, sốt. |
Triệu chứng hô hấp | Đau ngực, ho, khó thở, hội chứng ba giảm. |
Triệu chứng cận u và di căn | Đau đầu, đau cột sống, đau xương, đau bụng, khàn tiếng. |
Mô bệnh học | Đặc điểm giải phẫu bệnh bệnh phẩm sinh thiết tổn thương của bệnh nhân theo phân loại WHO 2014. |
Loại đột biến EGFR | Xóa đoạn trên exon 19 L858R trên exon 21 G719X trên exon 18 S768I trên exon 20 L861Q trên exon 21. |
Kích thước u trước điều trị | T1 (u≤3), T2 (3<u≤5), T3 (5<u≤7), T4 (>7) đánh giá dựa trên kích thước khối u trên CLVT. |
Vị trí khối u | Thùy trên phổi phải, thùy giữa phổi phải, thùy dưới phổi phải, thùy trên phổi trái, thùy dưới phổi trái. |
Di căn hạch | N0: không phát hiện được hạch N1: hạch quanh phế quản và/ hoặc hạch rốn phổi cùng bên N2: hạch trung thất cùng bên và/ hoặc hạch dưới carina N3: hạch trung thất và/ hoặc hạch rốn phổi đối bên. |
Vị trí di căn | Phổi, màng tim, não, xương, gan, tuyến thượng thận, hạch. |





