DANH MỤC BẢNG
Bảng 3.1. Phân bố theo nhóm tuổi của đối tượng nghiên cứu 22
Bảng 3.2. Phân bố theo giới của đối tượng nghiên cứu. 22
Bảng 3.3. Lí do vào viện của đối tượng nghiên cứu 23
Bảng 3.4. Các yếu tố nguy cơ của bệnh nhân UTBMTBG 24
Bảng 3.5. Giai đoạn ung thư biểu mô tế bào gan theo BCLC 24
Bảng 3.6. Phương pháp diều trị trước đây của bệnh nhân trong đợt nghiên cứu
..................................................................................................................... 25
Bảng 3.7. Chỉ số AFP của đối tượng nghiên cứu trước điều trị 25
Bảng 3.8. Đặc điểm khối u trước điều trị của đối tượng nghiên cứu 26
Có thể bạn quan tâm!
-
 Nhận xét đặc điểm xạ hình shunt gan - phổi trong phase I xạ trị trong chọn lọc bằng hạt vi cầu phóng xạ Y – 90 ở bệnh nhân ung thư biểu mô tế bào gan - 1
Nhận xét đặc điểm xạ hình shunt gan - phổi trong phase I xạ trị trong chọn lọc bằng hạt vi cầu phóng xạ Y – 90 ở bệnh nhân ung thư biểu mô tế bào gan - 1 -
 Điều Trị Ung Thư Biểu Mô Tế Bào Gan Bằng Phương Pháp Xạ Trị Trong Chọn Lọc – Selective Internal Radiotherapy (Sirt)
Điều Trị Ung Thư Biểu Mô Tế Bào Gan Bằng Phương Pháp Xạ Trị Trong Chọn Lọc – Selective Internal Radiotherapy (Sirt) -
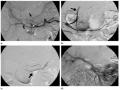
 Hình Ảnh Nút Bằng Coils Động Mạch Vị Tá Tràng Và Động Mạch Vành Vị Phải Trước Khi Bơm Dược Chất Phóng Xạ Vào Nhánh Mạch Nuôi U.
Hình Ảnh Nút Bằng Coils Động Mạch Vị Tá Tràng Và Động Mạch Vành Vị Phải Trước Khi Bơm Dược Chất Phóng Xạ Vào Nhánh Mạch Nuôi U. -
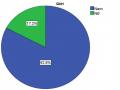
 Phân Bố Bệnh Theo Giới Của Đối Tượng Nghiên Cứu
Phân Bố Bệnh Theo Giới Của Đối Tượng Nghiên Cứu
Xem toàn bộ 70 trang tài liệu này.
Bảng 3.9. Đặc điểm shunt gan phổi của đối tượng nghiên cứu 27
Bảng 3.10. Sự liên quan của shunt gan phổi với đối tượng nghiên cứu 27

Bảng 3.11. Sự liên quan của shunt gan phổi với tình trạng xơ gan và các phương pháp điều trị trước đây 29
Bảng 3.12. Sự liên quan của shunt gan - phổi với số lượng khối u 30
DANH MỤC BIỂU ĐỒ
Biểu đồ 3.1. Phân bố bệnh theo giới của đối tượng nghiên cứu 23
Biểu đồ 3.2. Sự tương quan giữa giá trị shunt gan-phổi với độ tuổi của đối tượng nghiên cứu 28
Biểu đồ 3.4. Mối liên quan của shunt gan – phổi với kích thước khối u trước điều trị SIRT 31
DANH MỤC SƠ ĐỒ
Sơ đồ 2.1. Sơ đồ nghiên cứu 21
DANH MỤC HÌNH
Hình 1.1: Cấu trúc của máy SPECT 5
Hình 1.2: Tiêm truyền hạt vi cầu phóng xạ 90Y vào động mạch nuôi khối u gan
....................................................................................................................... 9
Hình 1.3: Hạt vi cầu 90Y và bình chứa 9
Hình 1.4: Hình ảnh shunt gan – phổi hai kĩ thuật SPECT và SPECT/CT 12
Hình 2.1: Hình ảnh nút bằng coils động mạch vị tá tràng và động mạch vành vị phải trước khi bơm dược chất phóng xạ vào nhánh mạch nuôi u 18
Hình 2.2: Xạ hình shunt gan phổi: Sau bơm dược chất phóng xạ 99mTc – MAA vào động mạch gan phải thấy rằng có sự tập trung 99mTc – MAA cao tại nhu mô phổi 2 bên (khung hình màu đỏ phổi phải – màu xanh phổi trái) 19
ĐẶT VẤN ĐỀ
Trên thế giới, ung thư biểu mô tế bào gan (UTBMTBG) là loại ung thư phổ biến đứng hàng thứ 6 về tỉ lệ mắc và là nguyên nhân gây tử vong do ung thư đứng hàng thứ 3 vào năm 2020[45, 51]. Theo GLOBOCAN 2020, tại Việt Nam, bệnh đứng đầu về tỉ lệ mắc, trên 40% bệnh nhân được chẩn đoán ở giai đoạn tiến triển[57].
UTBMTBG ở Việt Nam giai đoạn sớm có thể điều trị triệt căn bằng phẫu thuật hoặc đốt sóng khối u. Tuy nhiên, ở Việt Nam, đa số các ung thư gan nguyên phát thường phát hiện ở giai đoạn muộn. Lúc này phương pháp can thiệp chính là qua động mạch gan. Một trong số đó là phương pháp xạ trị trong chọn lọc (SIRT-Selective Internal Radiation Therapy) là một phương pháp điều trị mới, hiệu quả, ít biến chứng cho người bệnh. Ở Việt Nam, đây là phương pháp điều trị mới, được tiến hành từ năm 2013 và chỉ có một số cơ sở y tế lớn mới có thể triển khai thực hiện kĩ thuật này trong điều trị.
Phương pháp này được chỉ định cho bệnh nhân UTBMTBG không còn khả năng phẫu thuật, hoặc bệnh nhân từ chối phẫu thuật hoặc có chống chỉ định phẫu thuật, chức năng gan còn bù. Các hạt 90Y sẽ bị tắc nghẽn lại trong hệ thống lưới mao mạch trong khối u làm xơ tắc mạch máu tới khối u làm khối u bị thiếu dinh dưỡng mà chết đi đồng thời các hạt vi cầu còn phát tia bức xạ β tiêu diệt tế bào ung thư chọn lọc. Biến chứng của SIRT là khá hiếm gặp, nguyên nhân do các hạt vi cầu di chuyển tới vùng gan lành (gây suy gan) hoặc vào các cơ quan khác ngoài gan (dạ dày, túi mật) gây viêm do tia xạ. Viêm phổi do tia xạ là một trong những biến chứng có thể gặp của SIRT, để lại hậu quả nghiêm trọng bởi gây nên sự rối loạn chức năng thông khí hạn chế[44]. Do đó việc đánh giá shunt gan –phổi không những có giá trị trong việc tính toán liều Y-90 (chống chỉ định khi shunt >20 % và cần giảm liều tùy mức shunt) mà còn giúp giảm thiểu biến chứng lên phổi. Ở Việt Nam, đây là kĩ thuật khó và mới, bệnh viện Bạch Mai và bệnh viện Trung ương Quân đội 108 là 2 cơ sở đi đầu từ năm 2013. Chính vì vậy, chúng tôi tiến hành đề tài “Nhận xét đặc điểm xạ hình shunt gan phổi trong phase I xạ trị trong chọn lọc bằng hạt vi cầu phóng xạ 90Y ở bệnh nhân ung thư biểu mô tế bào gan” với 2 mục tiêu sau:
1. Mô tả một số đặc điểm lâm sàng và cận lâm sàng của các bệnh nhân ung thư biểu mô tế bào gan có chỉ định xạ trị trong chọn lọc bằng hạt vi cầu phóng xạ Y-90.
2. Nhận xét một số đặc điểm và yếu tố liên quan tới giá trị shunt gan
- phổi ở các bệnh nhân trên.
CHƯƠNG 1: TỔNG QUAN
1.1. CÁC VẤN ĐỀ VỀ UNG THƯ GAN
1.1.1. Định nghĩa
Ung thư biểu mô tế bào gan (HCC) là ung thư xuất phát từ tế bào gan, chiếm tới 75-85% các trường hợp ung thư gan, là loại ung thư có tỉ lệ mắc nằm trong 6 loại ung thư phổ biến nhất trên thế giới, nam mắc nhiều hơn nữ. Ở Việt Nam, theo thống kê năm 2018, đây là loại ung thư đứng hàng đầu về tỉ lệ mắc chung ở cả hai giới[2].
1.1.2. Dịch tễ ung thư biểu mô tế bào gan.
a, Dịch tễ ung thư biểu mô tế bào gan trên thế giới
Ung thư biểu mô tế bào gan (HCC) chiếm chủ yếu trong ung thư gan nguyên phát, đứng vị trí thứ 6 về tỉ lệ mắc và đứng thứ 3 về tỉ lệ tử vong do các bệnh ung thư trên toàn cầu, riêng đối với các nước phát triển, đây là bệnh có ảnh hưởng lớn[51]. Theo Globocan năm 2020 mỗi năm trên thế giới có thêm 905.677 ca mắc mới (chiếm 4,7%), số ca tử vong là 830180 (chiếm 8,3%), tỉ lệ mắc và tử vong ở nam giới gấp 2 đến 3 lần ở nữ giới, đặc biệt ở các nước thuộc khu vực Đông Á, Bắc Phi và Mông Cổ[51].
b, Dịch tễ ung thư biểu mô tế bào gan ở Việt Nam
Việt Nam là nước nằm trong khu vực có tỉ lệ mắc bệnh cao, theo Globocan 2020, UTBMTBG đứng đầu tỉ lệ mắc ở Việt Nam và đứng thứ 3 trong khu vực Châu Á, với tỉ lệ mắc theo giới ở nam và nữ tương ứng lần lượt là 38,0/100.000 dân và 9,8/100.000 dân[51].
Các yếu tố nguy cơ chính của nhiễm HCC vẫn là nhiễm virus viêm gan B (HBV), virus viêm gan C (HCV), rượu và tiếp đến là bệnh lý gan thoái hóa mỡ không do rượu (Non alcoholic fatty liver disease - NAFLD). Mặc dù vắc xin viêm gan B (VGB) được chính phủ cho phép đưa vào triển khai trong tiêm chủng mở rộng từ năm 1997, đến năm 2003 thì được triển khai trên toàn quốc cho trẻ <1 tuổi nhưng tỉ lệ vẫn còn thấp cụ thể trong giai đoạn 2010-2019, tỉ lệ tiêm vắc xin VGB liều sơ sinh ở Việt Nam là 70,5% trong đó cao nhất là vùng đồng bằng sông Cửu Long với 78,0% và thấp nhất là 55,5% ở vùng Trung du và miền núi phía Bắc[6]. Do vậy viêm gan virus B vẫn là nguyên nhân chính gây UTBMTBG. Ngoài ra, viêm gan do rượu với tỉ lệ mắc ngày càng cao cũng
là một trong những nguyên nhân đáng chú ý trong thời gian tới. Điều này đã đặt ra những yêu cầu cấp thiết trong công tác dự phòng cũng như khám sàng lọc chẩn đoán sớm đặc biệt là đối với những đối tượng nguy cơ cao nhằm phát hiện bệnh từ giai đoạn rất sớm để có thể điều trị sớm, giúp người bệnh có cuộc sống tốt hơn.
1.1.3. Các phương pháp chẩn đoán ung thư biểu mô tế bào gan
a, Triệu chứng lâm sàng
HCC ở giai đoạn sớm đa số có triệu chứng lâm sàng không rõ ràng, bệnh nhân thường đau bụng một cách mơ hồ, mệt mỏi, chán ăn, đầy bụng, khó tiêu nên dễ nhầm với các triệu chứng của bệnh gan mạn tính. Giai đoạn muộn bệnh biểu hiện rõ ràng hơn như: gầy sút nhanh, đau hạ sườn phải có thể sờ thấy khối u ở bụng nếu u to, gan to, một số trường hợp nghe có tiếng thổi khi khối u tăng sinh mạch nhiều, có thông động tĩnh mạch hoặc chèn ép mạch. Khi người bệnh đã có di căn, có thể sờ thấy hạch thường ở vùng hạ đòn phải. Tràn dịch màng phổi khi di căn phổi, đau xương khi di căn xương[8].
b, Các dấu ấn sinh học
Biomarket hay “dấu ấn sinh học” là những chất do khối u sinh ra hay do cơ thể phản ứng lại khối u sinh ra và có thể phát hiện thông qua các dịch sinh học và mô. Dấu ấn sinh học được sử dụng trong chẩn đoán, theo dõi và khám sàng lọc phát hiện sớm ung thư. Các dấu ấn sinh học được chẩn đoán trong ung thư biểu mô tế bào gan bao gồm hormone, kháng nguyên ung thư bào thai, các epitope carbonhydreate, các enzym, isoenzym, các sản phẩm của gen ung thư và đột biến gen. Trong đó AFP, AFP - L3 và PIVKA II là các dấu ấn sinh học được sử dụng phổ biến hiện nay[16, 17].
c, Chẩn đoán hình ảnh
- Siêu âm: được coi là kĩ thuật khá phổ biến, đơn giản và tin cậy trong sàng lọc ung thư gan. Siêu âm có thể phát hiện HCC ở giai đoạn bất kì với độ nhạy 84% nhưng với UTBMTBG giai đoạn sớm chỉ là 47%[53]. Siêu âm giúp đánh giá hình dạng, vị trí, số lượng, kích thước khối u gan, tình trạng bệnh lí gan nền, tình trạng dịch ổ bụng và các tổn thương khác kèm theo. Hình ảnh khối u khu trú trong gan có thể là giảm âm, tăng âm hay hỗn hợp[8].
- Chụp cắt lớp vi tính (CLVT) và cộng hưởng từ (CHT)
Hình ảnh điển hình có tiêm thuốc của khối u gan trong UTBMTBG là ngấm thuốc rất mạnh ở thì động mạch và thoái hóa nhanh ở thì tĩnh mạch. Khi chưa tiêm thuốc cản quang khối u có giảm tỉ trọng với nhu mô gan lành hoặc có tỉ trọng không đồng nhất do có hoại tử, vôi hóa chảy máu trong khối u. Độ nhạy và độ đặc hiệu của CLVT để phát hiện HCC lần lượt là 66,7% và 94,4%[43]. Chụp cộng hưởng từ có thể phát hiện những khối u có kích thước nhỏ, nhất là các khối u < 2cm, dựa vào sự khảo sát trên chuỗi xung, đặc biệt là MRI động và chuỗi xung khuếch tán rất nhạy trong chẩn đoán.
- Chụp cắt lớp phát xạ đơn photon (SPECT)
Kĩ thuật SPECT phát triển dựa trên cơ sở CT-Scanner. Nhưng trong SPECT không có chùm tia X nữa mà là các photon gamma của các ĐVPX đã được đưa vào cơ thể bệnh nhân dưới dạng các DCPX để đánh dấu đối tượng cần ghi hình[9]. Trong SPECT các tín hiệu cũng được ghi nhận như trong đầu dò của Planar Gamma Camera và đầu dò các kĩ thuật YHHN thông thường khác, nhưng trong SPECT đầu dò được quay xoắn với góc nhìn từ 180°, 360° (1/2 hay toàn vòng tròn cơ thể), được chia theo từng bậc với từng góc nhỏ (thông thường khoảng 3°). Tuy mật độ chùm photon được phát ra khá lớn, nhưng đầu dò chỉ ghi nhận được từng photon riêng biệt nên được gọi là chụp cắt lớp đơn photon. Tia X hoặc photon trước khi đến được đầu dò bị các mô tạng của cơ thể nằm trên đường đi hấp thụ, do vậy năng lượng của chúng bị suy giảm tuyến tính. Cho máy quét trên cơ thể hoặc bệnh nhân quay thì góc quay và góc nhìn của chùm tia quyết định hướng, mật độ chùm tia đến đầu dò và giá trị hấp thụ của nó. SPECT có thể phát hiện các tổn thương ngay từ giai đoạn rất sớm (mức độ tế bào, mức độ phân tử) nhưng không phải trong mọi trường hợp đều có thể dễ dàng khẳng định đó là tổn thương lành tính hay ác tính. Khi các dược chất phóng xạ vào cơ thể, chúng sẽ đi đến cơ quan cần khảo sát và cơ quan này sẽ trở thành nguồn phát phóng xạ và hình ảnh sẽ được hệ thống máy tính ghi lại. Hiện nay người ta chế tạo được các máy SPECT 1 đầu (detector), 2 đầu, 3 đầu. Các máy SPECT 2 và 3 đầu sẽ cho kết quả ghi hình nhanh hơn, đặc biệt khi cần khảo sát các quá trình động học xảy ra trong cơ thể. Ngoài ra, các máy SPECT vừa có thể tạo ra các lát cắt hình ảnh như CT, MRI, nó còn cho hình ảnh quét (Scan) toàn thân, đặc điểm này là đặc biệt có giá trị trong
phát hiện khối u và di căn ung thư. Sự kết hợp giữa SPECT với chụp CT mang lại hiệu quả chẩn đoán cao giúp xác định tổn thương giai đoạn sớm với định khu giải phẫu rõ ràng.
Máy SPECT bao gồm các bộ phận chính như trong hình 1.1 [9]
o Đầu dò và bàn điều khiển (Control Console): Đầu dò dùng tinh thể Nal (TI). Bức xạ phát ra từ tinh thể phát quang được khuếch đại bởi ống nhân quang và mạch vi điện tử. Đầu dò phải có độ phân giải cao, độ nhạy lớn, khoảng cách tới tạng là ngắn nhất và được gắn với ống định hướng thích hợp.
o Khung máy (Gantry): có mô tơ đều khiển quay được góc 180° - 360° quay quanh bệnh nhân theo những góc 3°- 6°.
o Hệ thống điện tử: Các tín hiệu được đưa vào mạch điện tử để lựa chọn, khuếch đại, ghi nhận sau đó hệ thống này chuyển đổi từ tín hiệu nhấp nháy sang tín hiệu số (digital) để lưu trữ.
o Máy tính với các phần mềm thích hợp: trong đó có bộ nhớ các dữ liệu và bàn điều khiển và kĩ thuật hiệu chỉnh dựa trên thuật toán tin học (lọc nền, xoá bỏ lỗi, thu tín hiệu theo từng đơn vị thể tích) từ đó cho phép ghi hình cắt lớp.
o Trạm hiển thị: cho thấy hình ảnh cụ thể và lưu giữ cho máy tính lọc và tái tạo hình ảnh.
Hình 1.1: Cấu trúc của máy SPECT
(Nguồn Mai Trọng Khoa (2012), Y học hạt nhân, Nhà xuất bản Y học Hà Nội)
- Chụp cắt lớp bức xạ positron (PET) và PET/CT, PET/MRI
Kĩ thuật chụp PET thường sử dụng hoạt chất phóng xạ 18-F-2-fluoro-2- deoxy-D-glucose (FDG), một chất có cấu trúc tương tự như glucose để chẩn đoán nhiều loại ung thư khác nhau. Cơ sở của phương pháp này là dựa vào động học của enzym (glucose-6-phosphatase), đối với khối UTBMTBG biệt hóa cao sẽ có nồng độ glucose-6-phosphatase cao do hiện tượng tăng chuyển hoá từ đó bắt FDG nhiều hơn còn với những khối ung thư biệt hóa kém thì ngược lại. Tuy nhiên, độ nhạy của FDG thấp trong việc phát hiện HCC, từ 40% đến 68%, chủ yếu là do hoạt tính của enzym glucose-6-phosphatse tương đối cao được tìm thấy trong HCC mức độ biệt hóa thấp[32].
Sự kết hợp PET/CT cho phép khai thác tối ưu các lợi thế của PET, giúp phát hiện các tổn thương di căn sớm ngoài gan so với các phương tiện chẩn đoán hình ảnh khác[9]. Với ưu điểm đánh giá được đặc điểm chuyển hóa của tổ chức u (xảy ra trước cả khi có thay đổi về hình thái), cho nên PET/CT là phương pháp rất có giá trị trong theo dõi và đánh giá đáp ứng điều trị.
Tương tự như PET/CT, PET/MRI là sự kết hợp giữa ưu điểm của chụp cộng hưởng từ (MRI), bao gồm tăng độ tương phản mô mềm, nhiều chuỗi, không tiếp xúc với bức xạ ion hóa, và sử dụng chất tương phản đặc hiệu cho MRI, kết hợp với ưu điểm của PET.
1.1.5. Các phương pháp điều trị ung thư biểu mô tế bào gan[8]
Phẫu thuật cắt bỏ khối ung thư là phương pháp điều trị rất tốt đặc biệt là đối với các u ở giai đoạn sớm hoặc khu trú ở một thùy hoặc phân thùy của gan. Với tỉ lệ sống thêm 5 năm hiện nay đạt trên 50%[26]. Gần đây, phẫu thuật cắt gan nội soi đang ngày càng phát triển, với kết quả sống thêm tương tự như phẫu thuật cắt bỏ thông thường nhưng giảm mất máu, hồi phục sau mổ nhanh hơn và tỉ lệ biến chứng sau mổ thấp hơn[41]. Đây là một kĩ thuật khó đòi hỏi trang thiết bị và phẫu thuật viên có trình độ cao nên mới chỉ được thực hiện ở một số trung tâm lớn. Riêng ở Bệnh viện Bạch Mai, tháng 8/2019 là lần đầu tiên các bác sĩ tại đây thực hiện thành công kĩ thuật cắt gan nội soi cho bệnh nhân được chẩn đoán UTBMTBG.