chính xác và hiệu quả để giải quyết nhu cầu sản lượng lương thực ngày càng cao trên thế giới [42], [87].
1.2.2. Ứng dụng nano kim loại trong vi nhân giống thực vật
Nuôi cấy mô tế bào thực vật là phương pháp cốt lõi của ngành công nghệ sinh học thực vật; có vai trò quan trọng đối với việc bảo tồn, nhân giống hàng loạt, kỹ thuật di truyền, sản xuất các hợp chất thứ cấp. Trong những năm gần đây việc ứng dụng các hạt nano đã thành công trong việc loại bỏ nấm và vi sinh vật trong khử trùng bề mặt mẫu cấy, bổ sung vào môi trường nuôi cấy nhằm kiểm soát nhiễm nấm và vi khuẩn, phát sinh hình thái, tạo cây hoàn chỉnh đã được báo cáo thông qua Bảng 1.5 và Bảng 1.6.
Bảng 1.5. Một số nghiên cứu và ứng dụng nano kim loại trên thế giới
Nội dung Nano Loài thực vật Nguồn
Khử trùng bề mặt 100 mg/L AgNPs
trong 180 phút
200 mg/L AgNPs
trong 15 phút
Có thể bạn quan tâm!
-
 Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 2
Nghiên cứu tác động của nano bạc và nano sắt lên chất lượng cây giống in vitro ở một số cây trồng có giá trị kinh tế - 2 -
 Tác Nhân Khử Trùng, Nồng Độ Kết Hợp Với Thời Gian Xử Lý Trong Khử Trùng Mẫu Cấy
Tác Nhân Khử Trùng, Nồng Độ Kết Hợp Với Thời Gian Xử Lý Trong Khử Trùng Mẫu Cấy -
 Một Số Nghiên Cứu Phát Sinh Hình Thái Trên Cây Salem, Dâu Tây, Sâm Ngọc Linh
Một Số Nghiên Cứu Phát Sinh Hình Thái Trên Cây Salem, Dâu Tây, Sâm Ngọc Linh -
 Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây
Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây -
 Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy
Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy -
 Phương Pháp Phân Tích Định Lượng Saponin (G-Rg1, M-R2, G-Rb1)
Phương Pháp Phân Tích Định Lượng Saponin (G-Rg1, M-R2, G-Rb1)
Xem toàn bộ 195 trang tài liệu này.
200 mg/L AgNPs
trong 20 phút
Valeriana officinalis [22]
Gerbera jamesonii [58]
Fragaria × ananassa [161]
100 mg/L AgNPs
trong 1 hoặc 5 phút
Arabidopsis thaliana, Lycopersicon esculentum, Solanum tuberosum
[102]
200 mg/L AgNPs
trong 180 phút
Araucaria excelsa [138]
500 mg/L AgNPs Kappaphycus striatus [107]
100 mg/L AgNPs
trong 7 phút
Gốc ghép (Prunus amygdalus × Prunus persica)
[27]
Bổ sung vào môi trường nuôi cấy nhằm kiểm soát nhiễm nấm và vi
400 mg/L AgNPs Olea europaea [132]
1% TiO2NPs Solanum tuberosum [134]
60 mg/L TiO2NPs Hordeum vulgare [103]
khuẩn
100 mg/L
ZnNPs or ZnONPs
Mousa sapientum [74]
150 mg/L AgNPs Gốc ghép (Prunus
amygdalus × Prunus persica)
[27]
Khử trùng môi trường nuôi cấy
Bổ sung vào môi trường vi thuỷ canh nhằm kiểm soát nhiễm nấm và vi khuẩn
4 mg/L AgNPs Chrysanthemum spp. [158]
7,5 mg/L AgNPs Chrysanthemum spp. [159]
Tái sinh chồi 25 hoặc 50 mg/L AgNPs
Vanilla planifolia [149]
Nhân nhanh chồi 2,0 mg/L AgNPs Rosa hybrida L. [68]
Cảm ứng mô sẹo, tái sinh cây
15 mg/L ZnONPs Solanum lycopersicum [24]
Cảm ứng mô sẹo 8 mg/L AgNPs Solanum nigrum [57] 25 – 500 mg/L CNPs Satureja khuzestanica [64]
Tạo cây hoàn chỉnh 50 mg/L AgNPs Brassica juncea [142]
1 – 20 mg/L ZnONPs
Brassica nigra [170]
10 mg/L AuNPs Arabidopsis thaliana [91] 4,65 µg/L CoNPs Rosa hybrida L. [68] 0,75 mM FeNPs Dianthus caryophyllus [115]
5 mg/L CuSO4NPs Verbena bipinnatifida [63]
Bảng 1.6. Một số nghiên cứu và ứng dụng nano kim loại ở Việt Nam
Nội dung Nano Loài thực vật Nguồn
Khử trùng bề mặt mẫu cấy
0,5 g/L AgNPs
trong 15 phút
Saintpaulia ionantha [12]
0,1 g/L AgNPs
trong 15 phút
Passiflora edulis Sims.
Passiflora edulis
f. flavicarpa
[3]
Khử trùng môi trường nuôi cấy
4 mg/L AgNPs Chrysanthemum spp. [14]
Tăng trưởng và kháng vi sinh vật
Sinh trưởng, phát triển trong môi trường rắn
Sinh trưởng, phát triển trong môi trường lỏng
Sinh trưởng, phát triển trong môi trường thuỷ canh
7,5 mg/L AgNPs Chrysanthemum spp. [18]
1,5 mg/L AgNPs Chrysanthemum spp. [97]
1,5 mg/L AgNPs Chrysanthemum spp. [97]
5 mg/L AgNPs Chrysanthemum spp. [97]
Sinh trưởng, phát triển trong môi trường rắn
Sinh trưởng, phát triển trong môi trường vi thuỷ canh in vitro
Sinh trưởng, phát triển trong môi trường vi thuỷ canh
75 mM FeNPs Chrysanthemum
morifolium Ramat. cv. "Jimba"
100 mM FeNPs Chrysanthemum
morifolium Ramat. cv. "Jimba"
75 mM FeNPs Chrysanthemum
morifolium Ramat. cv. "Jimba"
[160]
[160]
[160]
Sinh trưởng của rễ tơ 1,5 mg/L CuNPs Panax vietnamensis Ha
et Grushv.
[6]
Nhân nhanh chồi 2 mg/L AgNPs Rosa hybrida [8]
2 mg/L AgNPs Gerbera jamesonii [9] Tạo cây hoàn chỉnh 5 mg/L AgNPs Gerbera jamesonii [9]
10 mg/L AgNPs Chrysanthemum spp. [13]
10 mg/L AgNPs Fragaria spp. [13]
5 mg/L AgNPs Gerbera jamesonii [13]
3 mg/L AgNPs Gerbera jamesonii [8]
10 mg/L FeNPs Chrysanthemum spp. [16]
1.2.3. AgNPs và FeNPs trong vi nhân giống thực vật
1.2.3.1. AgNPs trong vi nhân giống thực vật
Cơ chế tác dụng của bạc trong vi nhân giống
Một đặc tính phổ biến của bạc (Ag) đã được biết trên toàn thế giới trong nhiều thế kỷ qua đó là tính kháng vi sinh vật. Từ xa xưa, người ta sử dụng đặc tính này của Ag để phòng bệnh: người cổ đại đã sử dụng các bình bằng Ag để lưu trữ nước, rượu
dấm; ở thế kỷ XX, người ta thường đặt một đồng Ag trong chai sữa để kéo dài độ tươi của sữa; chúng còn được dùng rộng rãi trong điều trị các vết bỏng và khử trùng vết thương. Sau khi thuốc kháng sinh được phát minh và đưa vào ứng dụng với hiệu quả cao, người ta không còn quan tâm đến tác dụng kháng khuẩn của Ag nữa. Tuy nhiên, từ những năm gần đây do hiện tượng các chủng vi sinh ngày càng trở nên kháng thuốc kháng sinh, con người bắt đầu quan tâm trở lại đối với việc ứng dụng kim loại Ag vào khả năng diệt khuẩn hay các ứng dụng khác; đặc biệt dưới dạng Ag có kích thước hạt nano [143]. Các đặc tính kháng khuẩn của Ag bắt nguồn từ tính chất hoá học của các ion Ag+. Ion này có khả năng liên kết mạnh với peptidoglycan
- thành phần cấu tạo nên thành tế bào của vi khuẩn - ức chế khả năng vận chuyển oxy vào bên trong tế bào dẫn đến làm tê liệt vi khuẩn. Nếu các ion Ag được lấy ra khỏi tế bào thì khả năng hoạt động của vi khuẩn lại được phục hồi. Khác với vi sinh vật, động vật không có thành tế bào, nên ion Ag+ không thể gây tổn thương cho con người hay động vật [143]. Sau khi Ag+ tác động lên lớp màng bảo vệ của tế bào vi khuẩn gây bệnh, nó sẽ đi vào bên trong tế bào và phản ứng với nhóm sulfhydryl-SH của phân tử enzyme chuyển hoá oxy và vô hiệu hoá enzyme này dẫn đến ức chế quá trình hô hấp của tế bào vi khuẩn. Các ion Ag+ còn có khả năng liên kết với các base của DNA và trung hoà điện tích của gốc phosphate do đó ngăn chặn quá trình sao chép DNA [143]. Ngoài ra Ag+ còn có khả năng phân tán ổn định trong các loại dung môi khác nhau, độ bền hoá học cao, không bị biến đổi dưới tác dụng của ánh sáng hay các tác nhân oxy hoá khử thông thường, ổn định ở nhiệt độ cao và chi phí cho quá trình sản suất thấp [81]. Do vậy, các ion Ag+ trước nay được biết đến như một loại ion khoáng có khả năng kháng khuẩn cao, ổn định và an toàn trong quá trình sử dụng.
Mặt khác, Bạc (Ag) là một kim loại không được bổ sung thường qui vào môi trường nuôi cấy, mà chỉ được thêm vào môi trường nuôi cấy để điều tiết sự phát sinh hình thái, tăng trưởng và phát triển của cây trồng dưới dạng ion Ag+ trong muối nitrat bạc (AgNO3) và sulfate bạc (AgSO4) thông qua ức chế sinh tổng hợp của khí ethylene. Một mặt, Ag có thể ngăn ngừa sự tổng hợp ethylene và làm đảo lộn vùng bám dính của ethylene. Thụ thể ETR1 có thể liên kết với ethylene thông qua một trung tâm hoạt động là tiểu phần có 1 ion đồng (Cu+). Sự thay thế Cu+ bằng Ag+ khiến cho thụ thể
không thể liên kết với ethylene và ngăn ngừa các tín hiệu ức chế của ethylene lên thực vật. Điều này có thể là do sự giống nhau về kích thước, cùng trạng thái oxy hóa của cả ion Cu+ và ion Ag+ trong việc tạo thành phức chất với ethylene [176]. Mặt khác trong thực vật, polyamin đóng một số vai trò quan trọng như phân chia tế bào, phát sinh hình thái, sinh tổng hợp protein, nhân đôi DNA và giúp cây đáp ứng lại các tác nhân stress sinh học. Các nghiên cứu đã cho thấy mối tương quan chặt chẽ giữa ethylene, các polyamine và SAM. Trong mối tương quan này, cả ethylene và các polyamine điều có chung tiền chất là SAM cho sự sinh tổng hợp của chúng, do đó, việc sử dụng những chất ức chế sinh tổng hợp ethylene như AgNO3 sẽ khiến cho SAM không đi theo con đường sinh tổng hợp ethylene, cũng đồng nghĩa với việc SAM được chuyển hóa thành các polyamine nhiều hơn và tiến trình phát sinh hình thái được kích hoạt [92].
Ứng dụng AgNPs trong vi nhân giống
Với kích thước nhỏ hơn 20 nm, AgNPs sẽ có diện tích bề mặt lớn giúp tăng khả năng tiếp xúc với không gian bên ngoài, sự bám dính lên bề mặt tế bào gia tăng dẫn đến hiệu quả tác động và hoạt tính của AgNPs cao hơn so với ion Ag+ [169]. Theo tính toán lý thuyết AgNPs có hoạt tính mạnh hơn ít nhất 40 lần trên mỗi đơn vị bạc so những dung dịch keo bạc thông thường. Vì vậy, các nhà khoa học có thể sử dụng ít bạc hơn để đạt được hiệu quả tương đương. AgNPs ảnh hưởng đến sự sinh trưởng, phát triển của cây trồng bằng cách gây ra những biến đổi đáng kể ở mức độ sinh lý và phân tử theo hướng tích cực hoặc tiêu cực tùy theo loài thực vật, kích thước, cấu trúc và nồng độ AgNPs sử dụng. AgNPs không những có hiệu quả cao trong việc kháng vi sinh vật mà còn được biết đến với những tác động tích cực lên sự phát sinh hình thái, sinh trưởng và phát triển của cây vi nhân giống [33], [137]. Một số nghiên cứu đã cho thấy, AgNPs có khả năng thúc đẩy sinh trưởng, phát triển của nhiều loài thực vật bằng cách tăng cường các quá trình biến dưỡng trong cây như sinh tổng hợp chlorophyll, tổng hợp carbohydrate, protein và các enzyme chống oxy hóa [135], [142]. Ngoài tác dụng kháng vi sinh vật rất mạnh, dựa vào tính chất vật lý của hạt AgNPs hấp thu ánh sáng có bước sóng 390 – 420 nm, nên tại bước sóng này cường độ ánh sáng được thực vật hấp thu mạnh. Do đó, cây phát triển trên môi trường có bổ
sung AgNPs thường tươi hơn, cao hơn, sinh trưởng tốt hơn, giảm hiện tượng rụng lá gây ra bởi ethylene, duy trì được màu xanh lá cây đậm hơn do tích lũy chlorophyll mạnh hơn so với cây trên môi trường không bổ sung [135]. Nhiều nghiên cứu đã chứng minh được tác dụng của ion bạc là chất ức chế sinh tổng hợp khí ethylene trong nuôi cấy mô bằng cách làm đảo lộn liên kết ethylene và ngăn chặn các tín hiệu ức chế của ethylene lên thực vật bao gồm các tác động tiêu cực như thủy tinh thể, rụng lá, giảm hàm lượng chlorophyll dẫn đến chết cây khi chuyển ra điều kiện tự nhiên [175]. Thêm vào đó, AgNPs còn được nghiên cứu như là các elicitor (còn gọi là nanoelicitor) [90]. Tuy nhiên, những tác động tiêu cực của AgNPs với thành tế bào thực vật là không thể tránh khỏi khi xử lý ở nồng độ cao hoặc trong thời gian dài và những tác động tiêu cực đó vẫn chưa được làm rõ.
1.2.3.2. FeNPs trong vi nhân giống thực vật
Cơ chế tác dụng của sắt trong vi nhân giống
Trong vi nhân giống thực vật, sắt (Fe) là chất dinh dưỡng cần thiết cho sự tăng trưởng mô, tế bào thực vật; hoạt động như một cofactor của các enzyme và tham gia vào các quá trình quan trọng như quang hợp, sao chép DNA và hô hấp [55]. Để đáp ứng được nhu cầu sử dụng muối sắt của thực vật in vitro, FeSO4.7H2O thường được dùng kết hợp với EDTA (Ethylenediamine Tetra Acetate) tạo phức hợp Fe-EDTA, nhằm ổn định các muối sắt trong môi trường, tăng cường khả năng hấp thu đối với thực vật và bảo vệ chúng khỏi quá trình oxy hóa. Đây là dạng chelate không bị kết tủa và được giải phóng dần tùy theo nhu cầu của thực vật. Tuy nhiên, Fe-EDTA thường ổn định ở mức pH dưới 6,0; nếu pH trên 6,5 thì khoảng 50% sắt không hiệu quả. Cây trồng có 2 cơ chế để hấp thu sắt trong điều kiện hiếu khí được mô tả bởi Romheld và cộng sự (1986) (Hình 1.3) [130].
Cơ chế 1 được thể hiện rõ trong trường hợp thiếu hụt sắt, bằng cách giải phóng các proton, được thực hiện thông qua 3 con đường: (1) khử Fe3+ thành Fe2+ ở bề mặt rễ; (2) đẩy H+ thúc đẩy khử Fe3+ thành Fe2+; (3) giải phóng các chất khử và/hoặc chelate bởi rễ [75]. Các con đường này nhằm kích hoạt enzyme khử nằm trên màng sinh chất trong thành tế bào của vùng chóp rễ. Do đó, trong môi trường có pH bình
thường cây trồng có thể hấp thu sắt theo con đường thứ nhất. Ở cây dưa (Cucumis sativus L.) bị thiếu hụt sắt khi được cung cấp Fe3+ chelate thì tỷ lệ hấp thu sắt cao gấp 100 lần so với đối chứng được cung cấp đầy đủ sắt trong quá trình nuôi cấy; ngược lại, ở cây lúa mạch (Hordeum vulgare L.) không có enzyme khử thì tỷ lệ hấp thu sắt không cao khi được cung cấp sắt ở nghiệm thức tương tự [130]. Khi môi trường có độ pH cao hoặc thấp sẽ ức chế enzyme khử và quá trình tự oxy hoá Fe2+ diễn ra, dẫn đến sự khử Fe3+ giảm mạnh. Khi môi trường có độ pH cao cây trồng có thể hấp thu sắt theo con đường thứ hai là tác động đến enzyme xúc tác (H+-transporting ATPase (EC3.6.1.35)) làm giảm độ pH trong vùng trống và vùng rễ [131]. Trong nhiều trường hợp quá trình đẩy H+ do thiếu sắt có liên quan chặt chẽ đến những thay đổi trong cấu trúc tế bào rễ [129]. Quá trình đẩy proton và kích hoạt enzyme khử đồng thời ở chóp rễ đã cho thấy một hệ thống phản hồi phức tạp. Giảm độ pH từ 8 xuống 6 đã gia tăng sự khử Fe3+ thành Fe2+ trong rễ cây đậu phộng khoảng 20 lần [130]. Nhưng đối với môi trường có độ pH thấp thì khả năng đẩy proton không thể tạo pH cao để kích thích enzyme khử. Hiệu quả của cơ chế 1 phụ thuộc vào việc cung cấp sắt hoà tan (chủ yếu là chelates sắt) vào hệ thống enzyme khử theo con đường thứ 3 [130]. Trong một số điều kiện nhất định Fe3+ chelates được tạo ra bởi các vi sinh vật rhizosphere có thể thay thế các chất tiết ra ở rễ tạo thành chelates sắt hoà tan [80]. Tóm lại, cơ chế 1 là phức tạp và dựa vào nồng độ của sắt chelates hoà tan trong rễ. Tỷ lệ hấp thụ sắt bằng cơ chế 1 giảm khi cây trồng được trồng trên đất có độ pH quá cao hoặc quá thấp.
Cơ chế 2: Fe3+ sẽ chuyển thành dung dịch Fe2+ do phytosiderophores ở rễ cây tiết ra. Kết quả là ở các loài có thành phần này có khả năng hấp thu Fe3+ vô cơ ít hoà tan. Các phytosiderophores đã được xác định là axit iminocarboxylic thay thế các hydroxy và các amino (mugineic hoặc avenic acid). Các hợp chất này có liên quan về mặt hoá học với nicotianamine – một loại amino acid xuất hiện nhiều trong thực vật bậc cao. Sự giải phóng phytosiderophores khi cây bị thiếu sắt. Tỷ lệ hấp thu sắt có liên quan đến loại phytosiderophores [153]. Các nghiên cứu gần đây cũng cho thấy trạng thái dinh dưỡng của cây cũng liên quan đến hệ thống hấp thu này. Tuy nhiên, cách hấp thu sắt này có thể điều chỉnh được tốc độ giải phóng phytosiderophores và ít phụ thuộc vào nồng độ pH như cơ chế 1. Sự giải phóng phytosiderophores và sự
hấp thu Fe3+ phytosiderophores chỉ bị suy giảm nhẹ bởi pH, điều này có thể giải thích cho tính kháng cao hơn của các loài này đối với môi trường có độ pH quá cao hoặc quá thấp [130].
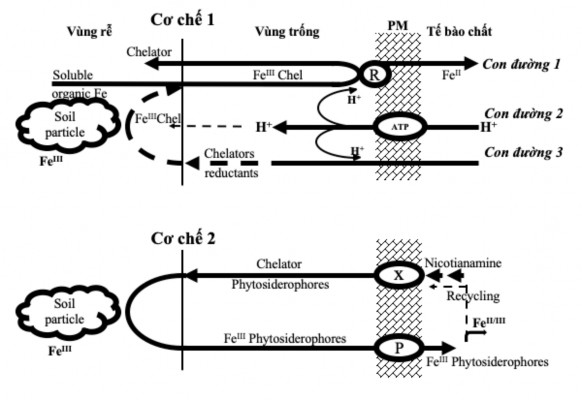
Hình 1.3. Cơ chế hấp thu sắt trong thực vật
Ứng dụng FeNPs trong vi nhân giống thực vật
Tương tự như AgNPs, FeNPs có tính ổn định và tính tan cao nên chúng có thể là nguồn vật liệu tiềm năng trong vi nhân giống. Đối với thực vật, các bằng chứng về các tác động tích cực của FeNPs lên thực vật đã được một số nhà khoa học chứng minh khi sử dụng ở nồng độ thấp. Các hạt FeNPs cho thấy khả năng thúc đẩy tăng trưởng và kéo dài rễ, tăng khả năng chống chịu với các stress sinh học và phi sinh học của thực vật [86], [99].
Almeelbi và Bezbaruah (2012) đã nghiên cứu cho thấy sự tăng cường đáng kể về sinh trưởng, phát triển và sinh khối thực vật của rau chân vịt (Spinacia oleracea) bằng FeNPs trong dung dịch thủy canh. Đáng lưu ý là hàm lượng sắt trong lá thân và rễ đã tăng gấp đôi khi sử dụng nano [25]. Amuamuha và cộng sự (2012) cũng đã nghiên cứu tác động của nồng độ khác nhau của nFe (1, 2 và 3 g/L) lên hoa cúc tâm