Tỷ lệ sống (%), số lá, chiều cao cây (cm), diện tích lá (cm2), khối lượng tươi (g) và chlorophyll (nmol/cm2) được ghi nhận sau 6 tháng trồng trong điều kiện vườn ươm. Cây con ở điều kiện vườn ươm (6 tuần) được chuyển qua rổ nhựa (45 x 65 cm, giá thể Klasmann TS1) để tiếp thụ theo dõi sự sinh trưởng và phát triển tiếp theo. Số lá, chiều cao cây (cm), diện tích lá (cm2) và khối lượng tươi (g) được ghi nhận sau 18 tháng trồng trong điều kiện vườn ươm. Cây con 18 tháng tuổi được chuyển qua chậu nhựa (30 x 40 cm) và đặt trong nhà kính với độ ẩm phải dao động từ 85 – 90%, nhiệt độ dao động từ 15 – 200C trong ngày, cường độ ánh sáng dao động từ 6 – 15 µmol.m- 2.giây-1 trong ngày. Khối lượng tươi (g), hàm lượng saponin (G-Rg1 (%), M-R2 (%), G-Rb1 (%) và G-Rg1 + M-R2 + G-Rb1 (%)) được ghi nhận sau 2 năm trồng trong điều kiện nhà kính.
2.3.2. Phương pháp theo dõi các chỉ tiêu
Số mẫu nhiễm
Tỷ lệ nhiễm (%) =
Tỷ lệ tái sinh (%) =
Tỷ lệ ra rễ (%) =
Tỷ lệ đậu trái (%) =
Tổng số mẫu Số mẫu tái sinh Tổng số mẫu Số mẫu ra rễ Tổng số mẫu Số hoa trên cây Số trái trên cây
× 100
× 100
× 100
× 100
Chiều cao cây (cm): được đo từ phần gốc đến đầu mép của lá dài nhất đối với cây salem và đến cuốn lá đối với cây dâu tây và sâm Ngọc Linh
Đường kính củ (cm): được đo từ bề mặt cắt ngan của củ Chiều dài củ (cm): được do từ phần gốc đến hết củ
Số lượng ngó: đếm số lượng ngó tạo thành sau 12 tuần làm thí nghiệm
Diện tích lá: Được do từ chiều dài và chiều rộng của lá và được tính bằng công thức: Diện tích = chiều dài × chiều rộng
Khối lượng tươi (g/mẫu): được xác định bằng cách cân khối lượng tươi.
Khối lượng khô (mg/mẫu hoặc g/mẫu): được xác định bằng cách cân khối lượng sau khi mẫu tươi được sấy ở 60oC cho đến khi khối lượng không đổi.
Chlorophyll (nmol/cm2): được xác định bằng máy đo SPAD-502 (Minolta Co., Ltd., Nhật Bản).
2.3.3. Phương pháp quan sát bề mặt mô sẹo
Phương pháp quan sát bề mặt mẫu mô sẹo có khả năng phát sinh phôi cây sâm Ngọc Linh được tiến hành theo các bước sau: (1) Mẫu được cố định trong dung dịch glutaraldehyte 2,5% trong 1 giờ ở 4oC; rửa mẫu bằng dung dịch cacodylate 0,1M (5 phút/lần, 3 lần); (2) Cố định lại mẫu bằng dung dịch OSO4 1% trong 15 phút ở nhiệt độ phòng, rửa mẫu bằng dung dịch cacodylate 0,1M (5 phút/lần, 3 lần). (3) Hút nước bằng cồn các nồng độ 50%, 70%, 80%, 90%, 100% (5 phút/lần, 3 lần); mẫu được để khô ở nhiệt độ phòng thí nghiệm. Sau khi đã khô, mẫu được đưa lên đế, phủ màng dẫn điện Platinum - Palladium. Sau đó mẫu được đưa vào buồng mẫu của kính hiển vi điện tử quét FE SEM S4800 (Hitachi) để quan sát và đọc kết quả [51].
2.3.4. Phương pháp giải phẫu thực vật
Tạo các lát cắt mỏng phôi, ngâm các mẫu đã cắt trong nước Javel 10% trong 15 phút. Rửa sạch mẫu bằng nước cất, tiếp theo ngâm mẫu trong acid acetic 15% trong 15 phút để cố định mẫu. Rửa sạch mẫu bằng nước cất cho đến khi hết mùi acid. Sau đó, ngâm mẫu trong phẩm nhuộm hai màu trong 5 phút; rửa lại mẫu bằng bình phun nhỏ giọt cho đến khi nước trong đĩa petri ngâm mẫu không còn màu phẩm nhuộm. Đặt mẫu lên lam kính, nhỏ lên mẫu một giọt nước cất, đậy lamelle lên và quan sát mẫu dưới kính hiển vi Olympus CH 30 ở vật kính x4 [5].
2.3.5. Phương pháp quan sát và đếm số lượng tế bào
Phương pháp xác định mật độ tế bào trong các bình nuôi cấy theo các bước sau:
(1) Huyền phù tế bào cây salem (1 mL) được thu nhận cho vào eppendorf, ly tâm 1500 vòng/phút trong 5 phút ở nhiệt độ phòng để loại bỏ dịch môi trường; (2) Mẫu sau khi ly tâm được cố định trong paraformaldehyde 4% trong 15 phút, ly tâm 1500 vòng/phút trong 5 phút ở nhiệt độ phòng để loại bỏ dịch nổi; (3) Dịch tế bào được ủ với triton X100 0,1% trong 30 phút, ly tâm 1500 vòng/phút trong 5 phút ở nhiệt độ
phòng để loại bỏ dịch nổi; (4) Các tế bào được thu nhận và nhuộm với thuốc nhuộm acridine orange nồng độ 30 µg/mL trong 30 phút, ly tâm 1500 vòng/phút trong 5 phút ở nhiệt độ phòng để loại bỏ dịch nổi; (5) 5 µL các tế bào được cố định trên lam kính, đậy lamelle lên và quan sát dưới kính hiển vi điện tử huỳnh quang (Olympus PX50) để xác định số lượng tế bào đơn [38].
2.3.6. Phương pháp xác định hàm lượng khí ethylene
Khí trong bình nuôi cấy kín được thu nhận trực tiếp bằng ống tiêm không rò rỉ khí (1 mL) và bơm vào hệ thống GC bằng phương pháp thủ công. Khí ethylene sau đó được định lượng bằng phương pháp sắc ký khí. Một cột thép không gỉ (3 m × 1,5 mm) chứa đầy chất hấp phụ - Porapack P, có kích thước hạt 80 – 100 Mesh đã được sử dụng. Nhiệt độ phát hiện cột, kim phun và ngọn lửa ion hóa lần lượt là 60oC và 90oC. Khí nitơ được sử dụng làm khí mang (55 mL/phút) sẽ đưa khí cần phân tích đến cột sắc ký [50].
2.3.7. Phương pháp xác định hàm lượng AgNPs hấp thụ
Hàm lượng hấp thụ AgNPs trong môi trường nuôi cấy được xác định bằng phương pháp quang phổ hấp thụ nguyên tử (AAS) [179]. Môi trường nuôi cấy được thu thập và phân huỷ bằng acid HNO3/HCl, sau đó 5 mL mẫu phân tích được chuyển thành khí chứa các ion tự do bằng cách sử dụng nguồn năng lượng phù hợp. Các mẫu dạng khí được phân tích bằng phương pháp quang phổ hấp phụ nguyên tử (AAS) trên máy quang phổ hấp phụ (Shimadzu, AAS-6650, Nhật Bản).
Tỷ lệ AgNPs hấp thụ:
Ag = Ag0 – AgT
Trong đó: Ag là tổng hàm lượng AgNPs được hấp thụ (µg/kg)
Ag0 là tổng hàm lượng AgNPs trong môi trường nuôi cấy lúc đầu (mg/L)
AgT là tổng hàm lượng AgNPs trong môi trường nuôi cấy (mg/L)
2.3.8. Phương pháp phân tích định lượng saponin (G-Rg1, M-R2, G-Rb1)
Củ của cây sâm Ngọc Linh 2 năm tuổi được thu nhận, rửa sạch, phơi khô và nghiền thành bột. Bột (0,5 g) được chiết hoàn toàn trong metanol bằng máy sonicator (10 mL metanol x 6 lần). Sau đó, dung dịch này được làm bay hơi bằng thiết bị bay hơi để làm khô cặn. Các chất cô đặc được hòa tan trong 20 mL nước và được phân đoạn bằng ethylic và n-butanol. N-butanol được cô trong áp suất chân không để thu được dịch chiết khô. Dịch chiết đã làm khô được hòa tan bằng hỗn hợp dung môi nước axetonitril (2:1) và được lọc qua màng 0,45 mm. Dịch lọc cuối cùng được đưa vào hệ thống HPLC để xác định định lượng saponin bằng cách sử dụng phương pháp đường chuẩn. Hệ thống HPLC: Cột Supelco RP C18 (250 mm x 4,6 mm; I.D. 5 mm) và máy dò SPD-M20A-PDA (Shimadzu) đã được sử dụng. Thông số HPLC: thể tích tiêm 20 mL; tốc độ dòng 0,5 mL/phút. Nhiệt độ cột được giữ ở 25°C [171].
![]() ĐIỀU KIỆN NUÔI CẤY
ĐIỀU KIỆN NUÔI CẤY
Điều kiện nuôi cấy in vitro: Các thí nghiệm được tiến hành trong điều kiện nhiệt độ phòng 25 ± 2oC, chu kỳ chiếu sáng 16 giờ/ngày, cường độ 40 – 45 µmol.m-2.s-1 dưới ánh sáng đèn huỳnh quang, độ ẩm trung bình 55 – 60%.
Điều kiện nuôi cấy ex vitro: Các thí nghiệm được tiến hành trong nhiệt độ ban ngày 27 ± 2oC, nhiệt độ ban đêm 14 ± 2oC, độ ẩm 65 – 70%, ánh sáng được che phủ 50 – 90% tuỳ thuộc vào từng thí nghiệm, giá thể được sử dụng là Klasmann TS1 với pH khoảng 5,5 – 6,5.
![]() ĐỊA ĐIỂM VÀ THỜI GIAN TIẾN HÀNH THÍ NGHIỆM
ĐỊA ĐIỂM VÀ THỜI GIAN TIẾN HÀNH THÍ NGHIỆM
Thí nghiệm nuôi cấy in vitro được thực hiện tại phòng Sinh học Phân tử và Chọn tạo giống cây trồng (Viện Nghiên cứu Khoa học Tây Nguyên), số 116, đường Xô Viết Nghệ Tĩnh, phường 7, thành phố Đà Lạt, tỉnh Lâm Đồng.
Thí nghiệm nuôi cấy ex vitro được thực hiện tại công ty cổ phần Công nghệ Sinh học Thái Dương, lô C18, khu quy hoạch viện Nghiên cứu hạt nhân, đường Hùng Vương, phường 11, thành phố Đà Lạt, tỉnh Lâm Đồng.
Thí nghiệm đo ethylene được thực hiện tại Viện Cây ăn quả miền Nam, QL1A, xã Long Định, huyện Châu Thành, tỉnh Tiền Giang.
Thí nghiệm xác định hàm lượng Ag được thực hiện tại Viện Nghiên cứu Hạt nhân, số 1, đường Nguyên Tử Lực, phường 8, thành phố Đà Lạt, tỉnh Lâm Đồng.
Thí nghiệm xác định mật độ tế bào được thực hiện tại Viện Sinh học Nhiệt đới, số 9/621, Xa lộ Hà Nội, khu phố Linh Trung, quận Thủ Đức, thành phố Hồ Chí Minh. Thí nghiệm quan sát bề mặt mô sẹo được thực hiện tại phòng hiển vi điện tử,
Viện Vệ sinh dịch tễ Trung ương, số 1, đường Yersin, thành phố Hà Nội.
Thí nghiệm xác định hàm lượng saponin được thực hiện tại Trung tâm Sâm và Dược liệu thành phố Hồ Chí Minh, số 41, đường Đinh Tiên Hoàng, phường Đa Kao, quận 1, thành phố Hồ Chí Minh.
Thời gian thực hiện thí nghiệm từ 11/2016 – 2/2021.
![]() PHƯƠNG PHÁP XỬ LÝ THỐNG KÊ
PHƯƠNG PHÁP XỬ LÝ THỐNG KÊ
Mỗi thí nghiệm được lặp lại 3 lần. Tất cả các số liệu sau khi thu thập ứng với từng chỉ tiêu theo dõi được xử lý bằng phần mềm MicroSoft Excel® 2017 và phần mềm phân tích thống kê SPSS 16.0 theo phương pháp Duncan’s test với = 0,05 [52].
CHƯƠNG 3. KẾT QUẢ VÀ BÀN LUẬN
![]() NGHIÊN CỨU ẢNH HƯỞNG CỦA AgNPs LÊN KHỬ TRÙNG BỀ MẶT VÀ CẢM ỨNG MẪU CẤY
NGHIÊN CỨU ẢNH HƯỞNG CỦA AgNPs LÊN KHỬ TRÙNG BỀ MẶT VÀ CẢM ỨNG MẪU CẤY
3.1.1. Ảnh hưởng của AgNPs lên khử trùng bề mặt và cảm ứng mẫu lá cây salem Phương pháp khử trùng bề mặt mẫu cấy phổ biến là sử dụng các chất hoá học thông dụng [Ca(ClO)2, HgCl2, …] có hoạt tính diệt nấm và vi khuẩn, nhưng những chất này lại gây hại đối với mẫu cấy và con người. Vì vậy, thí nghiệm này nhằm tìm ra loại chất khử trùng ở nồng độ và thời gian phù hợp có hiệu quả cao trong khử trùng bề mặt và cảm ứng mẫu cấy nhưng phải ít độc nhằm thay thế các chất khử trùng thông
dụng.
Mẫu lá được khử trùng bằng HgCl2 đã xuất hiện nấm sau 1 tuần nuôi cấy; trong khi đó, mẫu lá khử trùng bằng AgNPs chưa ghi nhận được tỷ lệ nhiễm. Do đó, bước đầu có thể thấy AgNPs có hiệu quả khử trùng vượt trội hơn so với HgCl2. Sau 2 tuần nuôi cấy, tỷ lệ nhiễm nấm và khuẩn bắt đầu được ghi nhận ở các nghiệm thức khử trùng bằng AgNPs. Kết quả cho thấy, các mẫu lá khử trùng với 0,05 g/L AgNPs trong 5 – 10 phút và 0,1 g/L AgNPs trong 5 phút bị nhiễm nấm hoàn toàn (Bảng 3.1). Sau 4 tuần nuôi cấy, tỷ lệ nhiễm của mẫu lá khử trùng bằng 0,2 g/L AgNPs trong 20 phút và 0,5 g/L AgNPs trong 15 phút là thấp nhất (26,66%) trong thí nghiệm (Bảng 3.1). Bên cạnh đó, tỷ lệ nhiễm của các mẫu cấy được xử lý bằng AgNPs tăng khi thay đổi nồng độ hay thời gian khử trùng so với nồng độ tối ưu của AgNPs (0,2 g/L AgNPs trong 20 phút và 0,5 g/L AgNPs trong 15 phút) (Bảng 3.1). Vì vậy, ở các nghiệm thức khử trùng bằng AgNPs sự thay đổi cả về nồng độ và thời gian đều có ảnh hưởng tích cực đến hiệu quả của quá trình khử trùng.
Bảng 3.1. Ảnh hưởng của AgNPs lên khử trùng bề mặt và cảm ứng mẫu lá cây salem sau 4 tuần nuôi cấy
Nồng | Thời | Tỷ lệ nhiễm | Tỷ lệ tái | Khối | ||
khử | độ | gian | và hoại tử | sinh mô sẹo | lượng | Hình thái mẫu |
trùng | (g/L) | (phút) | (%) | (%) | tươi (g) |
Có thể bạn quan tâm!
-
 Ứng Dụng Nano Kim Loại Trong Vi Nhân Giống Thực Vật
Ứng Dụng Nano Kim Loại Trong Vi Nhân Giống Thực Vật -
 Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây
Hấp Thu, Vận Chuyển Và Chuyển Hóa Nano Kim Loại Trong Cây -
 Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy
Nghiên Cứu Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Cấy -
 Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Lá Cây Dâu Tây
Ảnh Hưởng Của Agnps Lên Khử Trùng Bề Mặt Và Cảm Ứng Mẫu Lá Cây Dâu Tây -
 Ảnh Hưởng Của Agnps Lên Sự Gia Tăng Số Lượng Tế Bào Từ Mô Sẹo Cây Salem Nuôi Cấy In Vitro
Ảnh Hưởng Của Agnps Lên Sự Gia Tăng Số Lượng Tế Bào Từ Mô Sẹo Cây Salem Nuôi Cấy In Vitro -
 Hình Thái Phôi Vô Tính Cây Sâm Ngọc Linh Ở Đối Chứng Và 1,6 Mg/l Agnps
Hình Thái Phôi Vô Tính Cây Sâm Ngọc Linh Ở Đối Chứng Và 1,6 Mg/l Agnps
Xem toàn bộ 195 trang tài liệu này.
20 | 71,11b | 28,88e | 0,53de | |||
30 | 73,33b | 26,66e | 0,54cd | Mô sẹo hoá nâu | ||
5 | 100,00a | - | - | Mẫu nhiễm | ||
10 | 70,00b | 30,00e | 0,53de | |||
0,1 | 15 | 68,89b | 31,11e | 0,54cd | Mô sẹo xốp | |
20 | 46,66c | 53,33d | 0,64b | |||
30 | 71,11b | 28,88e | 0,55c | Mô sẹo hoá nâu | ||
5 | 71,11b | 28,89e | 0,54cd | |||
AgNPs | 10 | 45,55c | 54,44d | 0,64b | Mô sẹo xốp | |
0,2 | 15 20 | 36,66de 26,66f | 63,33bc 73,33a | 0,73a 0,74a | Mô sẹo xốp, màu trắng sữa | |
30 | 70,00b | 30,00e | 0,53de | Mô sẹo hoá nâu | ||
5 | 71,11b | 28,89e | 0,52e | |||
10 | 44,44cd | 55,55cd | 0,65b | |||
0,5 | 15 | 26,66f | 73,33a | 0,73a | Mô sẹo xốp, màu xanh | |
20 | 35,55e | 64,44b | 0,73a | Mô sẹo xốp | ||
30 | 68,89b | 31,11e | 0,53de | Mô sẹo hoá nâu | ||
HgCl2 | 1 | 5 | 43,33cde | 56,66bcd | 0,64b | Mô sẹo cứng, |
0,05
5 100,00a* - -
10 100,00a - -
15 72,22b 27,77e 0,52e
Mẫu nhiễm Mô sẹo xốp
Mô sẹo xốp
ngả vàng
Ghi chú: *Những chữ cái khác nhau (a,b,c...) trong cùng một cột thể hiện sự khác biệt có ý nghĩa ở mức = 0,05 trong phép thử Duncan, ký hiệu (-) thể hiện những nghiệm thức không có mẫu thành công.
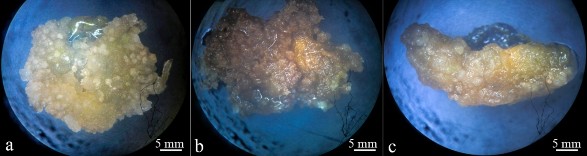
Hình 3.1. Sự cảm ứng khác nhau của các mẫu lá salem được khử trùng bằng AgNPs so với HgCl2 sau 4 tuần nuôi cấy
a: mẫu lá được khử trùng bằng 0,2 g/L AgNPs trong 20 phút; b: mẫu lá được khử trùng bằng 0,2 g/L AgNPs trong 30 phút c: mẫu lá được khử trùng bằng 1 g/L HgCl2 trong 5 phút; sau 4 tuần nuôi cấy.
Sau 4 tuần nuôi cấy, tỷ lệ tái sinh mô sẹo của mẫu lá khử trùng bằng 0,2 g/L AgNPs trong 20 phút và 0,5 g/L AgNPs trong 15 phút (73,33%) cao hơn so với các nghiệm còn lại (Bảng 3.1). Trong đó, tất cả các mẫu lá khử trùng bằng AgNPs có dấu hiệu cảm ứng mô sẹo sớm nhất trong tuần đầu tiên. Sau đó, các mẫu lá khử trùng bằng 1 g/L HgCl2 trong 5 phút cảm ứng mô sẹo sau tuần thứ ba trên cùng một môi trường thí nghiệm. Mặt khác, khối lượng tươi (0,73 – 0,74 g) của mô sẹo từ mẫu lá khử trùng với 0,2 – 0,5 g/L AgNPs trong thời gian 15 – 20 phút cao hơn so với với 1 g/L HgCl2 trong 5 phút (0,64 g). Đặc biệt, mẫu lá khử trùng với 0,2 g/L AgNPs trong 20 phút cho thấy sự phát triển của mô sẹo xốp có cấu trúc giống phôi, nhiều sơ khởi phôi có màu trắng sữa và xuất hiện rễ bất định là nguồn vật liệu tiềm năng cho quá trình phát sinh phôi hay huyền phù tế bào (Hình 3.1a); 0,5 g/L AgNPs trong 15 phút cho thấy sự phát triển của mô sẹo xốp có cấu trúc giống phôi, nhiều sơ khởi phôi có màu xanh. Các mẫu lá ở các nồng độ AgNPs còn lại cho thấy có sự xuất hiện các mô sẹo xốp với các mức độ khác nhau phụ thuộc vào nồng độ AgNPs và thời gian xử lý mẫu cấy. Bên cạnh đó, ở nồng độ 1 g/L HgCl2 trong 5 phút là các mô sẹo cứng có màu ngả vàng (Hình 3.1c). Ngoài ra, mẫu lá ở tất cả các nồng độ AgNPs trong thời gian 30 phút có sự ức chế sau 4 tuần nuôi cấy; mẫu bị hoá nâu và hoại tử (Hình 3.1b). Vậy, có thể thấy ở các mẫu lá được khử trùng bằng AgNPs trong thời gian dài sẽ gây hiện tượng ức chế mẫu cấy.