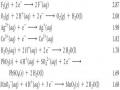2.4. Một số dụng cụ bằng sứ



a b c Hình 4. Các dụng cụ bằng sứ
Chén sứ (hình 4a): Dùng để nung các chất, đốt cháy các chất hữu cơ khi xác định tro… Chén sứ nung có thể chịu đến nhiệt độ 12000C trong lò nung.
Chày, cối sứ (hình 4b): Dùng để nghiền các hóa chất rắn.
Bát sứ (hình 4c): Dùng để cô cạn các dung dịch, trộn các hóa chất rắn với nhau, đun chảy các chất….
2.5 Một số dụng cụ khác
c

e
d
e

a b
f
Hình 5. một số dụng cụ khác
Giá sắt (hình 5a): Đi cùng với giá sắt còn có con bọ, các vòng, kẹp. Khi cặp ống nghiệm hay các loại bình phải có cao su lót nơi tiếp xúc giữa kẹp sắt và dụng cụ thủy tinh để tránh nứt vỡ.
Lưới amiăng (hình 5b): Khi đun nóng các bình thủy tinh bằng đèn cồn người ta thường dùng lưới ami ăng để tránh không cho bình thủy tinh tiếp xúc trực tiếp với ngọn lửa.
Giá đựng ống nghiệm (hình 5c): Giá đựng ống nghiệm thường làm bằng gỗ, thép không gỉ hay nhựa, dùng để úp ống nghiệm hoặc giá đỡ ống nghiệm khi tiến hành các thí nghiệm.
Kẹp gỗ (hình 5d) : Dùng để kẹp ống nghiệm, khi đã cho ống nghiệm vào kẹp rồi thì không nên dùng bàn tay lắm cả hai nhánh của kẹp mà chỉ cần cầm chắc một nhánh dài là được.
Đèn cồn (hình 5e): Dùng để đun nóng khi làm thí nghiệm. Khi dùng đèn cồn lưu ý là không được dùng miệng để thổi tắt đèn cồn mà phải dùng nắp úp vào, không được dùng đèn cồn này châm lửa cho đèn khác, không được đổ cồn quá đầy.
Bình tia (hình 5f): Bình thường được dùng để rửa kết tủa bám trên thành ống nghiệm; để rửa kết tủa trên giấy lọc; để rửa ống nghiệm bằng nước cất.
3. Những thao tác thực hành cơ bản trong phòng thí nghiệm
3.1. Rửa dụng cụ thí nghiệm
3.1.1. Phương pháp cơ học
Dụng cụ rửa là chổi lông. Tùy kích thước của bình, ống mà chọn chổi cho phù
hợp.
Đối với các chất bẩn tan được trong nước thì chỉ cần dùng nước thường hay nước
nóng là được. Đối với các chất không tan trong nước như chất béo,.. thì cần cho thêm các dung môi hữu cơ hay dầu rửa chén bát.
Khi rửa ống nghiệm chú ý không va chạm mạnh đầu và đuôi cuối chổi (bằng sắt) vào miệng và đáy ống nghiệm.
3.1.2. Phương pháp hóa học
- Ngâm (hoặc rửa) trong hỗn hợp sunfôcrômic
Cách điều chế hỗn hợp sunfôcômic: nghiền nhỏ 5g K2Cr2O7 rồi cho vào 100ml H2SO4 đặc, đun nhẹ 60 700 đến tan hết.
- Nếu dụng cụ dính dầu mỡ hay hợp chất hữu cơ thì rửa dụng cụ này bằng dung dịch KMnO4. Đợi 10 phút tại chỗ bám các chất hữu cơ sẽ có kết tủa MnO2, sau đó rửa sạch kết tủa ngày bằng HCl đặc hay dung dịch H2C2O4.
3.2. Lọc và rửa kết tủa
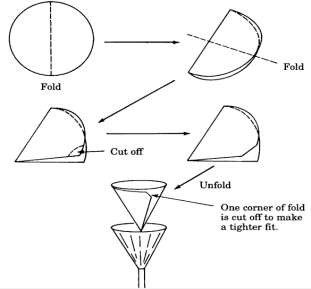
Muốn tách kết tủa ra khỏi dung dịch ra phải lọc và rửa kết tủa: dùng phễu lọc.
Các bước tiến hành như sau:
- Rửa sạch phễu lọc;
- Gấp giấy lọc đặt vào phễu, dùng nước tẩm ướt đều giấy lọc áp sát vào thành phễu;
- Đổ dung dịch chảy theo đũa thuỷ tinh vào giấy lọc, chất lỏng sẽ chui qua giấy lọc, kết tủa được giữ lại.
Muốn rửa kết tủa trên giấy lọc: đổ dung dịch rửa chảy theo đũa thuỷ tinh rưới đều bề mặt kết tủa
b
a
Hình 6. cách gấp giấy lọc (a), cách rót chất lỏng vào phễu có giấy lọc (b)
3.3. Cân và phương pháp cân
Cân là dụng cụ quan trọng nhất trong phòng thí nghiệm Hoá học. Tuỳ mức độ chính xác của công việc mà cân được chia thành nhiều loại với độ chính xác khác nhau. Thông thường trong phòng thí nghiệm Hoá học dùng hai loại cân chính sau:
a) Cân kỹ thuật: độ chính xác 0,01g;
b) Cân phân tích: độ chính xác 0,0001g.
Trong các loại cân nêu trên đang được sử dụng tại các phòng thí nghiệm Hoá học bao gồm nhiều chủng loại nhiều thế hệ như:
- Cân cơ học: (quang treo);
- Cân cơ học dùng điện (quang treo);
- Cân điện tử (hiện số).
Hiện nay thế hệ của cân điện tử hiện số đang được sử dụng rộng rãi với ưu điểm nổi trội là: Dễ sử dụng, kết quả cân có độ ổn định cao.
Sau đây là một số qui tắc chính trong sử dụng cân điện tử hiệu số:
- Đặt cân ngay ngắn trên bàn ở trong phòng không có gió (tốt nhất là trong phòng điều hoà nhiệt độ 200C). Độ thăng bằng của cân được kiểm tra bằng bọt nước trong cân (nếu có).
- Cắm điện vào nguồn 220V; bật công tắc (ON/OFF) cho cân làm việc; đợi khoảng 12 phút cho cân ổn định là có thể cân được.
- Hoá chất đem cân phải có bao bì mà không để trực tiếp lên đĩa cân (thí dụ: cân hoá chất rắn phải gói vào giấy không hút ẩm).
- Vật đem cân không được nóng quá hoặc lạnh quá. Nếu không phải chờ vật đạt đến nhiệt độ phòng mới đặt lên đĩa cân.
- Không cân vật có khối lượng lớn hơn trọng tải cho phép của cân.
- Không được dùng tay cân thử (đè lên đĩa cân). Không được đặt vật nặng lên cân (kể cả khi cân không cắm điện).
CÂU HỎI VÀ BÀI TẬP
1. Hãy nêu các bước làm sạch dụng cụ thuỷ tinh trong phòng thí nghiệm hoá học.
2. Quá trình đun nóng các phản ứng hoá học bằng ống nghiệm hoặc các dụng cụ thuỷ tinh khác phải làm như thế nào?
3. Hãy trình bày các nguyên tắc sử dụng cân điện tử hiện số.
4. Hãy tính lượng tinh thể Na2SO4, cần pha 500ml dung dịch Na2SO4 1M
BÀI 2. CÂN BẰNG HÓA HỌC-TỐC ĐỘ PHẢN ỨNG HÓA HỌC
1. Phần lý thuyết
Xem chương 4: Tốc độ phản ứng và cân bằng hóa học trong phần lí thuyết
2. Phần thực hành
Thí nghiệm 2.1. Ảnh hưởng của nồng độ tới cân bằng.
Hóa chất: dung dịch FeCl3; KSCN hoặc NH4SCN bão hòa; KCl hoặc NH4Cl tinh thể.
Dụng cụ: 4 ống nghiệm; cốc; pipet…
Cách tiến hành:
Rót 30ml nước cất vào cốc 50ml; thêm dung dịch bão hoà FeCl3 và KSCN, mỗi thứ 1- 2 giọt, quan sát màu đỏ sáng của hỗn hợp (nếu cần có thể pha loãng hỗn hợp bừng nước cất); chia đều hỗn hợp lỏng vào bốn ống nghiệm:
ống 1 giữ nguyên (dùng để so sánh),
ống 2 cho thêm vài giọt dung dịch FeCl3,
ống 3 cho thêm vài hạt tinh thể KCl và lác đều, ống 4 cho thêm vài giọt KSCN.
Quan sát và giải thích sự thay đổi cường độ màu sắc trong các ống nghiệm. Cân bằng chuyển dịch theo chiều nào?
Thí nghiệm 2.2.Ảnh hưởng của nhiệt độ tới cân bằng
Hóa chất: axit HNO3 đặc; Cu kim loại.
Dụng cụ: bình cầu; phễu nhỏ giọt; ống cao su…
Cách tiến hành:
Tiến hành điều chế NO2 từ axit HNO3 đặc và Cu.
Thu khí NO2 đỏ nâu vào hai bình cầu đáy tròn được thông với nhau bằng ống thuỷ tinh có khóa.
Đóng khóa, sau đó nhúng một bình vào cốc chứa nước
Hình 8. Thiết bị khảo sát ảnh hưởng của nhiệt độ tới cân bằng
đá và muối; bình kia nhúng vào cốc nước nóng già. Quan sát màu sắc ở hai bình. Giải thích?
Mở khóa và quan sát màu sắc ở hai bình và giải thích?
Thí nghiệm 2.3.Ảnh hưởng của nồng độ chất phản ứng đến tốc độ phản ứng trong hệ đồng thể.
Hóa chất: dung dịch Na2S2O3 0,2M; H2SO4 0,2M
Dụng cụ: ống nghiệm; pipet…
Cách tiến hành:
Dùng pipet cho vào 3 ống nghiệm mỗi ống 3ml axit sunfuric 0,2M.
Lấy 3 ống nghiệm khô khác đánh số thứ tự 1, 2, 3. Dùng pipet cho vào ống thứ nhất 1ml natri thiosunfat 0,2M và 2ml nước cất; ống thứ hai cho 2ml natri thiosunfat và 1ml nước cất; ống thứ 3 cho 3ml natri thiosunfat 0,2M. Lắc đều các ống nghiệm.
Đổ nhanh dung dịch axit sunfuric từ một trong 3 ống nghiệm đã chuẩn bị ở trên vào ống nghiệm 1, lắc đều. Dùng đồng hồ bấm giây theo dòi thời gian từ lúc đổ hai dung dịch vào nhau cho đến khi xuất hiện kết tủa đục sữa.
Tiến hành thí nghiệm với ống nghiệm 2 và 3 tương tự như ống nghiệm 1.
Chú ý quan sát kết tủa đục sữa như nhau trong các lần thí nghiệm, ghi kết quả vào bảng. Nhận xét và giải thích?
Thể tích (ml) | Tỉ lệ nồng độ Na2SO3 C1; C2; C3 | t(s) | v | 1 | V1;V2; V3 | ||||
| |||||||||
H2SO4 | Na2S2O3 | H2O | Tổng | ||||||
1 | |||||||||
2 | |||||||||
3 | |||||||||
Có thể bạn quan tâm!
-
 Đại Cương Về Các Chất Vô Cơ
Đại Cương Về Các Chất Vô Cơ -
 Hóa học đại cương - 24
Hóa học đại cương - 24 -
 Nêu Các Tính Chất Vật Lí Và Hoá Học Thể Hiện Sự Khác Nhau Giữa Kim Loại Và Phi Kim
Nêu Các Tính Chất Vật Lí Và Hoá Học Thể Hiện Sự Khác Nhau Giữa Kim Loại Và Phi Kim -
 Tính Ph Của Dung Dịch Amoni Clorua 0,1M Bằng 2 Phương Pháp:
Tính Ph Của Dung Dịch Amoni Clorua 0,1M Bằng 2 Phương Pháp: -
 Hóa học đại cương - 28
Hóa học đại cương - 28 -
 Hóa học đại cương - 29
Hóa học đại cương - 29
Xem toàn bộ 237 trang tài liệu này.
Thí nghiệm này có thể làm một cách định tính bằng cách tiến hành đổ đồng thời ống đựng axit sunfuric vào 3 ống nghiệm rồi quan sát mà không cần đo thời gian.
Thí nghiệm 2.4.Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Hóa chất: dung dịch KMnO4 0,05M; H2C2O4 0,1M; H2SO4 0,1M.
Dụng cụ: ống nghiệm khô; pipet; đồng hồ bấm giây…
Cách tiến hành:
Dùng pipet lấy vào ống nghiệm khô 2ml dung dịch kali pemanganat 0,05M và vào ống nghiệm khô khác 2ml dung dịch axit oxalic 0,1M, 2ml dung dịch H2SO4
0,1M. Sau đó trộn 2 dung dịch ở hai ống nghiệm vào nhau, dùng đồng hồ bấm giây ghi thời gian từ lúc trộn đến khi dung dịch mất màu hoàn toàn.
Tiến hành thí nghiệm tương tự như trên ở các nhiệt độ khác:
- Nhiệt độ phòng 300C;
- Nhiệt độ phòng 400C;
- Nhiệt độ phòng 500C
Các thí nghiệm được tiến hành trong bình điều nhiệt. Trước khi trộn hai dung dịch phải ngâm các ống nghiệm đựng các chất phản ứng trong bình điều nhiệt khoảng 10 phút để cho nhiệt độ của chúng bằng nhiệt độ của bình. Sau khi trộn 2 dung dịch không nhấc ống nghiệm ra khỏi bình điều nhiệt.
Ghi kết quả vào bảng, nhận xét và giải thích.
Nhiệt độ phản ứng (0C) | Thời gian t (s) | Tốc độ phản ứng v 1 t | |
Vẽ đồ thị sự phụ thuộc nhiệt độ của tốc độ phản ứng vào nhiệt độ. Nhận xét đồ thị thu được.
Thí nghiệm 2.5.Ảnh hưởng của chất xúc tác đồng thể đến tốc độ phản ứng
Hóa chất: C2H2O4 0,1M; H2SO4 0,1M; KMnO4 0,1M; MnSO4 0,1M.
Dụng cụ: ống nghiệm; buret; pipet
Cách tiến hành:
Lấy vào 2 ống nghiệm mỗi ống 2ml dung dịch axit oxalic 0,1M; 2ml axit sunfuric 0,1M.
Thêm vào ống nghiệm 1 vài giọt MnSO4 0,1M.
Cho vào cả hai ống nghiệm, mỗi ống 1ml dung dịch kali pemanganat 0,05M.
Quan sát sự mất màu trong hai ống nghiệm. Cho biết chất xúc tác ảnh hưởng như thế nào tới tốc độ phản ứng?
Thí nghiệm 2.6.Ảnh hưởng của chất xúc tác dị thể đến tốc độ phản ứng
Hóa chất: I2 tinh thể; bột Al. Dụng cụ: Chày cối sứ; bình tia…. Cách tiến hành:
Cho vào cối sứ khô một ít tinh thể iot; dùng chày sứ nghiền nhỏ sau đó thêm bột nhôm; trộn đều bằng đũa thuỷ tinh. Nhận xét có phản ứng xảy ra không?
Sau đó cho thêm vào vài giọt nước. Nhận xét phản ứng, nêu vai trò của nước đến tốc độ phản ứng. Viết phương trình phản ứng.
CÂU HỎI VÀ BÀI TẬP
Câu 1.
1.Dựa vào nguyên lí Lơ-Sa-Tơ-Li-ê, hãy giải thích vai trò của sự thêm KSCN, FeCl3 tới sự thay đổi vị trí cân bằng của phản ứng.
FeCl3 + KSCN
‡ˆ ˆˆ†ˆKCl + Fe(SCN)2+ +2Cl
2. Cân bằng hóa học của phản ứng 2NO2
theo chiều nào khi tăng nhiệt độ? Biết H0= 61,44kJ.
‡ˆ ˆˆ†ˆN2O4sẽ dịch chuyển
3. Tính hằng số cân bằng Kp, Kc đối với phản ứng đã cho ở (2) tại 500C, biết hỗn hợp cân bằng chứa 60% N2O4 về số mol.
Câu 2.
1. Tính hệ số nhiệt độ (hệ số Van Hop) của phản ứng trong những trường hợp sau
đây:
a) Ở 393K phản ứng kết thúc sau 18 phút; ở 453K phản ứng kết thúc sau 16 giây.
b) Khi hạ nhiệt độ xuống 450, phản ứng chậm đi 25 lần.
2. Tại sao trong các lần tiến hành đo tốc độ phản ứng ở thí nghiệm 1, 2, 3 tổng thể
tích của các dung dịch phản ứng phải cố định?
3. Giải thích như thế nào về vai trò chất xúc tác trong phản ứng xúc tác đồng thể và xúc tác dị thể.