men).
- Xúc tác enzym (xúc tác
zimaza
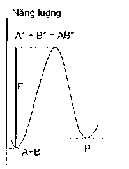
Tiến trình phản ứng
Hình 5.3. Đường biểu diễn biến đổi năng lượng trong quá trình phản ứng
Ví dụ: CgH12O6 → 2C2H5OH + 2CO2
Enzym là các chất xúc tác sinh học - chất xúc tác của cơ thể sống, nó có bản chất là protein.
Cơ chế và vai trò của xúc tác
Phản ứng có xúc tác thường diễn ra qua nhiều giai đoạn trung gian (tạo ra các hợp chất trung gian):
Ví dụ phản ứng giữa 2 chất A và B khi có mặt chất xúc tác K
K
A + B → C + D
Cơ chế diễn ra như sau: trước hết một trong những chất phản ứng sẽ phản ứng với chất xúc tác tạo ra một hợp chất trung gian [AK]*, sau đó hợp chất này lại phản ứng tiếp với chất phản ứng thứ hai tạo ra hợp chất trung gian [ABK]*. Cuối cùng [ABK]* phân huỷ tạo ra sản phẩm và hoàn trả lại chất xúc tác
A + K → [AK]* [AK]* + B → [ABK]* [ABK]* → C + D + K
Các hợp chất trung gian (có dấu sao) thường có năng lượng cao, không bền, chỉ tồn tại trong một khoảng thời gian rất ngắn của tiến trình phản ứng xúc tác.
Ví dụ:
Phản ứng thuỷ phân acetat ethyl có xúc tác H diễn ra như sau:
O OH
CH3-C+ H+ → CH3-C+
OC2H5 OC2H6
Hợp chất trung gian OH
OH
CH3-C+ H2O → CH3COOH + C2H5O+H2
OC2H5 Hợp chất trung gian C2H5O + H2 → C2H5OH + H+
Trong xúc tác dị thể các hợp chất trung gian hình thành giữa các nguyên tử trên bề mặt xúc tác và các chất phản ứng.
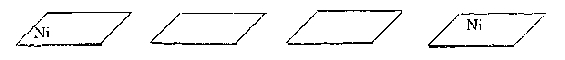
Ví dụ: phản ứng hydro hoá hydrocarbon không no có xúc tác Ni. RCH=CH2 H2 RCH-CH2H..H RCH2-CH2 H RCH2-CH3
Giai đoạn 1: sự hấp phụ các chất phản ứng lên bề mặt chất xúc tác.
Giai đoạn 2, 3: hình thành hợp chất trung gian và phản ứng trên bề mặt xúc tác.
Giai đoạn 4: tạo thành sản phẩm phản ứng và tách ra khỏi bề mặt.
Trong xúc tác enzym các chất phản ứng được gọi là cơ chất. Giữa cơ chất và trung tâm xúc tác của enzym hình thành các hợp chất trung gian enzym cơ chất.
Như vậy sự có mặt của chất xúc tác làm cho phản ứng diễn ra qua một số phản ứng trung gian có năng lượng hoạt hoá thấp hơn so với phản ứng không có xúc tác (hình 5.5) và do đó làm tăng tốc độ phản ứng.
Thông thường năng lượng hoạt hoá của nhiều phản ứng nằm trong nhưng giới hạn
sau:
E (kcal/mol) | |
Không xúc tác Xúc tác vô cơ Xúc tác enzym | 30 – 45 15- 30 8 - 1 2 |
Có thể bạn quan tâm!
-
 Nhiệt Sinh Tiêu Chuẩn, Entropy Tuyệt Đối Và Biến Thiên Năng Lượng Tự Do Sinh Tiêu Chuẩn Của Một Số Hợp Chất
Nhiệt Sinh Tiêu Chuẩn, Entropy Tuyệt Đối Và Biến Thiên Năng Lượng Tự Do Sinh Tiêu Chuẩn Của Một Số Hợp Chất -
 Năng Lượng Tự Do Và Tiêu Chuẩn Tự Diễn Biến Của Một Quá Trình
Năng Lượng Tự Do Và Tiêu Chuẩn Tự Diễn Biến Của Một Quá Trình -
 Nêu Một Vài Phương Pháp Xác Đinh Biến Thiên Năng Lượng Tự Do Của Phản Ứng. Thế Chuyển Nhóm Là Gì? Hãy Cho Biết Ý Nghĩa Của Bảng Thế Chuyển Nhóm.
Nêu Một Vài Phương Pháp Xác Đinh Biến Thiên Năng Lượng Tự Do Của Phản Ứng. Thế Chuyển Nhóm Là Gì? Hãy Cho Biết Ý Nghĩa Của Bảng Thế Chuyển Nhóm. -
 Mối Quan Hệ Giữa Hằng Số Điện Li Và Độ Điện Li
Mối Quan Hệ Giữa Hằng Số Điện Li Và Độ Điện Li -
 Phát Biểu Định Luật Đương Lượng Và Nêu Ứng Dụng Của Định Luật Đó Trong Tính
Phát Biểu Định Luật Đương Lượng Và Nêu Ứng Dụng Của Định Luật Đó Trong Tính -
 Hóa đại cương vô cơ - Đại học Tây Đô - 14
Hóa đại cương vô cơ - Đại học Tây Đô - 14
Xem toàn bộ 134 trang tài liệu này.

Các phản ứng xúc tác bằng enzym có năng lượng hoạt hoá thấp hơn nhiều so với những phản ứng không có xúc tác hoặc có xúc tác vô cơ. Do đó nó có thể làm cho các phản ứng trong cơ thể diễn ra vô cùng nhanh chống.
Ví dụ phản ứng phân huỷ hydro peroxyd: 2H2O2→ 2H2O + O2 .Nếu không có xúc tác thì đòi hỏi một năng lượng hoạt hoá là 35,96 kcal/mol. Khi có xúc tác platin E = 24,02 kcal/mol, còn khi được xúc tác bằng enzym citalaza chỉ cần một năng lượng hoạt hoá 14 kcal/mol.
Một số đặc điểm của xúc tác
- Chất xúc tác chỉ có thể làm tăng tốc độ của phản ứng mà không thể gây ra được phản ứng. Điều này có nghĩa là đối với những phản ứng không có khả năng xảy ra khi xét về tiêu chuẩn nhiệt động học thì không thể tìm được chất xúc tác cho nó.
- Chất xúc tác làm tăng tốc độ phản ứng thuận bao nhiêu lần thì cũng làm tăng tốc dộ phản ứng nghịch bấy nhiêu lần.
- Chất xúc tác có tính chọn lọc. Một chất xúc tác thường chỉ có thể xúc tác cho một phản ứng hoặc một loại phản ứng nhất định. Tính chọn lọc thể hiện đặc biệt rõ đối với các enzim vì vậy người ta thường nói các enzym có tính đặc hiệu cao.
- Một lượng nhỏ chất xúc tác có thể xúc tác cho một lượng lớn chất phản ứng. Sở dĩ như vậy là vì, về nguyên tắc, xúc tác không bị thay đổi sau phản ứng.
5.2 CÂN BẰNG HOÁ HỌC
5.2.1 Phản ứng thuận nghịch - Hằng số cân bằng
Phản ứng thuận nghịch là phản ứng diễn ra theo hai chiều
A + B K1 K2
C + D
Ví dụ: CH3COOC2H + H2O CH3COOH + C2H5OH
Tốc độ phản ứng thuận vt = k1 [A] [B] Tốc độ phản ứng nghịch vn = k2 [C] [D]
Trong quá trình phản ứng tốc độ phản ứng thuận giảm dần còn tốc độ phản ứng nghịch tăng dần. Khi vt = vn người ta nói phản ứng đạt tới trạng thái cấn bằng:
k1[A]' [B]' = k2 [C]' [D]'
K
C
k1 C'D'
k A'B'
2
Từ đó rút ra:
(5.6)
Như vậy KC là tỉ số giữa tích số nồng độ các chất sản phẩm phản ứng và tích số nồng độ các chất tham gia phản ứng nó được gọi là hằng số cân bằng của phản ứng.
KC là đại lượng đặc trưng cho một cân bằng, KC có giá trị càng lớn chứng tỏ cân bằng chuyển nhiều hơn theo chiều thuận.
5.2.2 Nguyên lí chuyển dịch cân bằng Le chatelier
"Khi một trong những điều kiện tồn tại của cân bằng như: nồng độ, nhiệt độ, áp suất bị thay đổi thì cân bằng sẽ chuyển dịch theo chiều chống lại tác dụng thay đổi đó"
Ví dụ 1: FeCl3 + 3KSCN Fe(SCN)3 + 3KC1
vàng nhạt đỏ đậm
Khi cân bằng đã được thiết lập nếu ta thêm vào hệ một ít tinh thể KC1 ta nhận thấy màu nhạt đi. Điều đó chứng tỏ cân bằng đã chuyển dịch theo chiều nghịch tức là chiều làm giảm bớt nồng dộ KCl. Ngược lại màu đỏ sẽ đậm lên nếu ta thêm KSCN hay FeCl3 chứng tỏ cân bằng đã chuyển dịch theo chiều thuận đã làm giảm nồng độ các chất thêm vào.
Ví dụ 2: N2 + 3H2 2NH3 ΔH<O
Phản ứng theo chiều thuận toả nhiệt làm cho hệ nóng lên đồng thời lại tạo ra ít số phân tử hơn do đó làm giảm áp suất trong hệ. Vì vậy nếu giảm nhiệt độ (làm lạnh hệ phản ứng) thì cân bằng sẽ chuyển dịch theo chiều thuận là chiều toả nhiệt. Nếu tăng áp suất (ví
dụ bằng cách nén hệ) thì cân bằng sẽ phải chuyên dịch theo tạo ra ít số phân tử hơn, tức là chiều thuận.
Trong tổng hợp amoniac, để tăng hiệu suất của phản ứng người ta thường thực hiện ở áp suất rất cao và nhiệt độ tương đôi thấp.
5.2.3 Hằng số phân li acid, base
Đối với các phản ứng thuận nghịch là sự phân li không hoàn toàn của các acid hoặc base thì hằng số cân bằng chính là hằng số phân li acid (Ka) hoặc hằng số phân li base (Kb).
Ví dụ: CH3COOH CH3COO- + H+ , Ka
CH COO
CH COO .H
3
Khi đó: K a
3
Ví dụ: NH3 + H2O NH4+ + OH- , Kb
NH .OH
Khi đó:
Kb
4
NH 3
Dựa vào giá trị hằng số phân li của acid, base người ta có thể so sánh độ mạnh, yếu của chúng.
CÂU HỎI VÀ BÀI TẬP
5.1. Nồng độ các chất phản ứng ảnh hưởng đến tốc độ phản ứng như thế nào? Hãy phát biểu và viết biểu thức của định luật tác dụng khối lượng. Bậc phản ứng là gì?
5.2. Phân biệt bậc phản ứng và phân tử số của phản ứng.
5.3. Phản ứng 2NO + O2 → 2NO2 là một phản ứng đơn giản. Tốc độ phản ứng thay đổi như thế nào khi:
Tăng nồng độ O2 lên 4 lần
Tăng nồng độ NO và O2 lên 3 lần.
5.4. Nhiệt độ ảnh hưỡng như thế nào đến tốc độ phản ứng, thể hiện qua biểu thức và qui tắc nào?
5.5. Một phản ứng có kệ số nhiệt độ γ =3,1. Hỏi khi tăng nhiệt độ thêm 40° tốc độ
phản ứng tăng lên bao nhiêu lần.
5.6. Hệ số nhiệt độ của một phản ứng bằng 3. Hỏi cần phải tăng nhiệt độ lên bao
nhiêu độ để tốc độ phản ứng tăng lên 243 lần.
5.7. Trinh bày nội dung cơ bản của thuyết hoạt hoá. Năng lượng hoạt hoá của một phản ứng là gì?
5.8. Tại sao sự có mặt của chất xúc tác lại làm tăng tốc độ phản ứng. Vẽ và giải thích giản đồ năng lượng của phản ứng khi có và không có mặt chất xúc tác.
5.9. Hằng số cân bằng của một phản ứng là gì? Hãy phát biểu và minh hoạ nguyên lí chuyển dịch cân bằng qua các ví dụ.
Các cân bằng sau đây chuyển dịch thế nào khi tăng nhiệt độ, khi tăng áp suất:
A. N2 + O2 2NO ∆H > 0
B. 2CO + 2 H2 CH4 + CO2 ∆H < 0
C. CaO + CO2 CaCO3 ∆H < 0
d. N2O4 2NO2 ∆ H > 0
5.11. Thế nào là phản ưng thuận nghịch, phản ứng nối tiếp? Cho ví dụ.
5.12. Cho ví dụ về phản ứng dây chuyền. Những giai đoạn cơ bản của một phản
ứng dây chuyền.
CHƯƠNG 6
ĐẠI CƯƠNG VỀ DUNG DỊCH
Mục tiêu bài học: sau khi học xong chương này sinh viên có khả năng:
1. Định nghĩa đúng và tính toán được các loại nồng độ khác nhau sử dụng trong dung dịch.
2. Định nghĩa đúng dung dịch chất điện li.
2. Nhận biết và tính toán được pH của dung dịch acid, base.
4. Định nghĩa đúng và phân biệt được các loại dung dịch đệm.
6.1 ĐỊNH NGHĨA VÀ PHÂN LOẠI DUNG DỊCH
Dung dịch là một hệ đồng nhất của hai hay nhiều chất có tỉ lệ khác nhau.
Ví dụ: dung dịch NaCl, dung dịch NH3, O2 trong nước.
Trong các dung dịch này nước là môi trường hoà tan, được gọi là dung môi, các chất khác gọi là các chất tan.
Theo bản chất của chất tan người ta phân chia thành ;
- Dung dịch không điện li: chất tan tồn tại trong dung dịch dưới dạng phân tử. Ví dụ: C2H5OH, O2 trong nước.
- Dung dịch điện li: trong dung dich có mặt cả phân tử và ion. Ví dụ dung dịch của các muối, acid, base... trong nước.
6.2 NỒNG ĐỘ DUNG DỊCH
Nồng độ dung dịch là đại lượng biểu thị lượng chất tan trong dung dịch. Trong thực tế có một số cách biểu thị nồng độ như sau:
6.2.1 Nồng độ phần trăm. Kí hiệu %
Nồng độ phần trăm biểu thị bằng số gam chất tan trong l00gam dung dịch.
C% mCT
mdd
x100%
(6.1)
Ví dụ: Dung dịch nước muối sinh lý 5% (trong 100 gam dung dịch có 5 gam
NaCl)
6.2.2 Nồng độ mol hay mol/lít. Kí hiệu M
Nồng độ mol được biểu thị bằng số mol chất tan trong l lít dung dịch.
C nCT
MV
(6.2)
dd
Ví dụ: Dung dịch NaOH 0,1M là dung dịch có 0,4167gam NaOH (1mol NaOH) trong l lít dung dịch.
6.2.3 Nồng độ đương lượng. Kí hiệu N
Nồng độ đương lượng được biểủ thị số đương lượng gam chất tan trong 1 lít dung
dịch.
CN
Với mCT: Khối lượng chất tan (g)
E; Đương lượng gam của chất tan (g) Vdd: Thể tích dung dịch (lít)
Đương lương gam của một chất là lượng chất đó tính bằng gam trong phản ứng kết
hợp (hay thay thế) 1mol nguyên tử hydro (l,008g).
Cách xác định số đương lượng gam (γ)
E M
(6.3)
Nếu là acid, n là số H+ có trong phân tử acid.
γ = ∑H+
Ví dụ: γHCl = 1
Nếu là base, n là số OH- có trong phân tử base.
γ = ∑OH-
Ví dụ: γNaOH = 1
Nếu là muối, n bằng tổng số hóa trị của các kim loại (hoặc phi kim) có trong muối.
γ = ∑(+) = ∑(-)
Ví dụ: γNaCl = 1
Nếu là chất oxy hóa hoặc chất khử, n là số electron cho hay nhận của chất đó.






