UTV di căn có biểu lộ quá mức yếu tố phát triển biểu bì Her 2 neu từ năm 1998, trastuzumab thường được phối hợp với các đơn hóa chất trong điều trị UTV di căn [35].
1.3.6. Điều trị đích trong ung thư vú
Cùng với sự phát triển hiểu biết về sinh học của ung thư vú, một số thuốc trong điều trị đích UTV đã được đưa vào sử dụng như trastuzumab, lapatinib, pertuzumab...trong đó trastuzumab được sử dụng rộng rãi trong điều trị bổ trợ UTV giai đoạn sớm sau phẫu thuật hoặc điều trị giai đoạn di căn ở bệnh nhân có Her-2/neu dương tính làm tăng thời gian sống thêm không bệnh và sống thêm toàn bộ.
1.4. Tổng quan về The Epidermal Growth Factor Receptor
1.4.1. Khái niệm The Epidermal Growth Factor Receptor
Họ protein ErbB là các thụ thể bề mặt tế bào, khi được các thành viên của họ yếu tố tăng trưởng biểu bì kích hoạt, sẽ kích hoạt hoạt động tyrosine xuyên màng, dẫn đến kích thích nhiều con đường dẫn truyền tín hiệu.
Thụ thể yếu tố tăng trưởng biểu bì (Epidermal Growth Factor Receptor) là thụ thể trên bề mặt tế bào tham gia vào các con đường tín hiệu điều khiển sự phân chia và tồn tại của tế bào. Thụ thể yếu tố tăng trưởng biểu bì là một tyrosine kinase xuyên màng (TK) được kích hoạt bằng cách liên kết các phối tử ngoại bào của họ ErbB và tham gia vào việc kích hoạt con đường tín hiệu MAPK, dẫn đến tăng sinh tế bào [36].
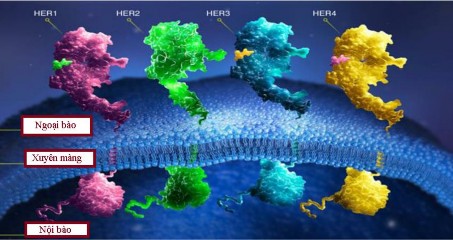
Thụ thể yếu tố tăng trưởng biểu bì bao gồm bốn phân loại: EGFR (ErbB1, HER1); ErbB2 (neu, HER2); ErbB3 (HER3); ErbB4 (HER4). Hình 1.1. minh
họa họ thụ thể ErbB. Tất cả thành viên trong ErbB có cấu trúc giống nhau: các protein gắn vào màng tế bào chất có chung cấu trúc và trình tự tương đồng, miền ngoại bào liên kết với phối tử ngoại trừ HER2, một miền lipophilic xuyên màng và miền nội bào (đuôi carboxyl) cùng với sự hoạt động tyrosine kinase [37].
Có thể bạn quan tâm!
-
 Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 1
Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 1 -
 Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 2
Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 2 -
 Mô Phỏng Protein Docking Với 60 Phối Tử Và Chất Chứng
Mô Phỏng Protein Docking Với 60 Phối Tử Và Chất Chứng -
 Thể Hiện Tương Tác Trastuzumab Với Protein 3Pp0. Các Chất Chứng Cũng Cho Thấy Khả Năng Liên Kết Với Một Số Acid Amin Quan Trọng Trong Nhóm Lys753, Val734,
Thể Hiện Tương Tác Trastuzumab Với Protein 3Pp0. Các Chất Chứng Cũng Cho Thấy Khả Năng Liên Kết Với Một Số Acid Amin Quan Trọng Trong Nhóm Lys753, Val734, -
 Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 6
Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 6 -
 Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 7
Đánh giá tác dụng ức chế enzym her2 của các hợp chất isoflavone trong định hướng điều trị ung thư vú bằng phương pháp docking phân tử - 7
Xem toàn bộ 57 trang tài liệu này.
Hình 1.1. Họ thụ thể ErbB [37].
1.4.2. HER2 trong ung thư và các chất ức chế HER2
Gen HER2 có thể đóng một vai trò trong sự phát triển của ung thư vú và được phát hiện lần đầu tiên trên chuột vào năm 1984 bởi nhóm của Weinberg [38]. Mối liên hệ với bệnh ung thư vú sau đó đã được xác định bởi Dennis Slamon. Ông phát hiện ra rằng protein HER2 có ở mức cao trong khoảng 30% trường hợp ung thư vú [39]. Sự biểu hiện của gen HER2 được kích hoạt chủ yếu thông qua quá trình khuếch đại gen và dẫn đến việc kích hoạt mạng lưới tín hiệu HER2. HER2 tạo ra các con đường tín hiệu MAPK (RAS-RAF-MEK- ERK) và các con đường phosphatidylinositol 3-kinase (PI3K) (PI3K-AKT- mTOR) dẫn đến tăng sinh tế bào, hình thành mạch và kiểm soát sự phát triển của khối u [40].
Các thụ thể HER tồn tại dưới dạng dimer, đồng nhất hoặc dị phân. Sự kích hoạt các con đường tín hiệu HER2 xảy ra bằng phản ứng dị hóa với HER1, HER3 hoặc HER4 hoặc bằng cách dimer hóa khi HER2 hiện diện ở nồng độ cao, như trong ung thư vú [41]. Trong số các cặp ErbB, cặp HER2 với HER3 là chất kích hoạt mạnh nhất chuỗi tín hiệu PI3K/ AKT. Hơn nữa, các dị thể chứa HER2 tạo ra các tín hiệu nội bào mạnh hơn đáng kể so với các tín hiệu phát ra từ các tổ hợp HER khác. Trong các tế bào bình thường, rất ít phân tử HER2 tồn tại trên bề mặt tế bào, do đó rất ít dị vật được hình thành và tín hiệu tăng trưởng tương đối yếu và có thể kiểm soát được. Khi HER2 được biểu hiện quá mức, nhiều dị phân tử HER2 được hình thành và tín hiệu tế bào mạnh hơn, dẫn đến tăng cường khả năng đáp ứng với các yếu tố tăng trưởng và tăng trưởng ác tính. Điều này giải thích tại sao sự biểu hiện quá mức của HER2 là một dấu
hiệu cho thấy tiên lượng xấu trong các khối u vú và có thể dự đoán về đáp ứng với điều trị. HER2 là một mục tiêu cụ thể và đầy hứa hẹn cho các phương pháp điều trị ung thư vú mới [42].
Hiện nay một số chất ức chế HER2 được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để điều trị ung thư vú dương tính HER2 như trastuzumab, neratinib, tucatinib, lapatinib, pertuzumab. Trastuzumab bám vào phần bên ngoài protein HER2, ức chế sự biệt hóa, tăng sinh và tăng trưởng của tế bào ung thư mà ít ảnh hưởng đến các tế bào bình thường. Lapatinib là một chất ức chế tyrosine kinase đường uống (TKI) ức chế ngược chiều HER2 kinase [43]. Pertuzumab là một kháng thể đơn dòng liên kết với HER2 trên miền ngoại bào II, ngăn chặn sự hình thành đồng nhất và dị hình, đồng thời ngăn chặn một trong những dị thể mạnh nhất - HER2 / HER3, kích hoạt một số dòng tín hiệu nội bào bao gồm tăng sinh tế bào và duy trì sự sống. Một số chất ức chế CDK4 /6 như ribociclib, abemaciclib [44]. Olaparib và talazoparib là chất ức chế PARP, đây là họ enzym liên quan đến sữa chữa DNA, ổn định bộ gen và chết tế bào theo chương trình [45]. Kusunokinin ức chế sự phát triển của tế bào ung thư vú, gây ra sự tắc nghẽn chu kỳ tế bào, quá trình apoptosis và bắt giữ tế bào ở pha phân bào (G2/M) [46]. Việc nhắm vào các protein mục tiêu như CDK4, CDK6, PARP, PI3K, HER2 trong điều trị ung thư vú đang được nghiên cứu rộng rãi và cho thấy sự khả quan về kết quả.
1.5. Tổng quan về isoflavone
Isoflavone là một phân lớp của flavonoid có cấu trúc diphenylpropan (C6
- C3 - C6) [47]. Sự khác biệt về cấu trúc chính giữa isoflavone và flavone là tạiđó carbon của vòng C, vòng B được đặt trong khung flavonoid. Vòng B trongisoflavone được gắn với C-3, trong khi vòng của flavone ở C-2. Hình 1.2 thể hiện cấu trúc đặc trưng của nhóm Isoflavone. Isoflavone phân bố rộng rãi trong họ thực vật họ Leguminosae, đặc biệt là đậu nành (Glycine max L.) và cỏ ba lá đỏ (Trifolium pratense L.), một số thực vật có ở mức độ thấp hơn như ở đậu gà (Cicer arietinum L.), cỏ linh lăng (Meticago sativa L) [48].
Hình 1.2. Cấu trúc của nhóm Isoflavone
Sau khi chuyển hóa trong ruột người, một số Isoflavone chuyển đổi thành S-equol, một hợp chất có cấu trúc tương tự như Estrogen [49]. S-equol ưu tiên liên kết với Erβ và có biểu hiện phiên mã cao hơn Isoflavone. Bằng chứng dịch tễ học cho thấy phụ nữ châu Á ăn nhiều đậu nành hơn có liên quan đến việc giảm gần một phần ba nguy cơ ung thư vú. Tác dụng ức chế khối u của Isoflavone đã được chứng minh trong các dòng tế bào ung thư vú và trên mô hình động vật. Do cấu trúc hóa học của chúng, Isoflavone cạnh tranh với estrogen nội sinh để liên kết với các thụ thể estrogen, làm giảm tác dụng nội tiết tố của estrogen nội sinh, chất mà mạnh hơn nhiều so với Isoflavone. Các tác dụng chống ung thư khác cũng được thử nghiệm bao gồm ức chế sự hình thành khối u, ức chế protease, thyrosine kinase và hình thành mạch [50]. Ngoài ra Isoflavone trong đậu nành còn làm giảm nồng độ cholesterol tổng và LDL cholesterol, tăng tỉ trọng khoáng chất trong xương cột sống, cải thiện điều hòa đường huyết trong ống nghiệm.
1.6. Kỹ thuật docking phân tử
1.6.1. Đại cương về phương pháp docking phân tử
Docking là một kỹ thuật mô hình hóa dùng để nghiên cứu, định hướng khả năng, tư thế gắn kết giữa protein với một cấu trúc hoặc phân tử nhỏ khác, có thể là protein, ARN, AND, nhằm tăng cường hoặc ức chế chức năng sinh học của protein này. Docking phân tử là một trong số các phương pháp phổ biến nhất trong thiết kế thuốc dựa trên cấu trúc bởi độ chính xác khá cao khi dự đoán cấu trúc của các phối tử phân tử nhỏ trong vị trí liên kết đích phù hợp [51]. Không những định hướng khả năng liên kết bởi các hàm tính điểm, docking còn chỉ ra những liên kết có ý nghĩa [52]. Về mặt nhiệt động học, mục tiêu
chính của docking là tìm ra một phức hợp ổn định với năng lượng liên kết thấp nhất.
Nhiều thuật toán lấy mẫu đã được phát triển và sử dụng rộng rãi trong các phần mềm docking phân tử có thể kể đến như: thuật toán so khớp (MA)- dựa trên nguyên tắc về khoảng cách giữa các nhóm chức trong phân tử protein và phối tử; các phương pháp xây dựng tăng dần (IC)- đưa phối tử vào vị trí hoạt động của protein theo kiểu phân mảnh và thêm dần các mảnh; phương pháp Monte Carlo 14 (MC)- tạo ra các tư thế của phối tử thông qua chuyển động quay liên kết, tịnh tiến thân cố định hoặc quay, các thuật toán di truyền (GA) với cảm hứng từ thuyết tiến hóa của Darwin, tạo ra một tập các tư thế của phối tử bằng cách đột biến và trao đổi chéo; mô phỏng động lực học phân tử (MD)- dự đoán sự di chuyển của từng nguyên tử riêng biệt trong trường của các nguyên tử còn lại theo thời gian dựa trên các phương trình động học, thể hiện tính linh hoạt của cả phối tử và protein hiệu quả hơn các thuật toán khác [53].
Docking thường bao gồm hai phần: thứ nhất đó là thử các hình dạng của phối tử trong vị trí hoạt động của protein để tìm ra các kiểu hình của phức hợp tiềm năng. Tiếp theo đó là dự đoán năng lượng tương tác của mỗi kiểu hình phức hợp, sau đó đưa ra đánh giá và xếp hạng [54].
Chức năng tính điểm được phát triển để mô tả nhanh chóng và chính xác sự tương tác giữa protein và phối tử. Ngoài việc xếp hạng các cấu trúc, định hướng của phối tử khi liên kết với vị trí hoạt động thông qua độ bền của liên kết, chức năng tính điểm còn dự đoán ái lực liên kết protein- phối tử, ứng dụng trong tối ưu hóa hợp chất dẫn đường cũng như sàng lọc các hợp chất tiềm năng đối với một đích trong các cơ sở dữ liệu lớn [55]. Năng lượng tự do của phức hợp protein- phối tử được cho bởi hằng số liên kết (Kd) và năng lượng tự do Gibbs (ΔG), trong đó xét đến các tương tác như Van der Waals, liên kết kị nước, liên kết Hydro, liên kết cộng hóa trị, liên kết tĩnh điện và dự đoán về năng lượng liên kết được thực hiện bằng cách đánh giá những tương tác hóa lý quan trọng bao gồm: các tương tác liên phân tử, các ảnh hưởng solvat và entropy [52]. Số lượng các tham số hóa lý càng lớn thì độ chính xác càng cao. Tuy nhiên, thời gian tính toán sẽ lâu nếu số lượng biến lớn. Vì vậy, các hàm tính điểm cần cân bằng giữa độ chính xác và tốc độ để đạt được hiệu quả khi làm việc với các cơ sở dữ liệu lớn.
1.6.2. Quy trình Docking
Quá trình docking được thực hiện thông qua ba bước: chuẩn bị cấu tử, chuẩn bị protein, mô phỏng docking.
Chuẩn bị cấu tử
Cấu trúc các cấu tử có thể được lấy từ hệ thống dữ liệu có sẵn như ZINC, Pubchem, Asinex database. Trong trường hợp không có sẵn, chúng ta có thể xây dựng cấu trúc cấu tử bởi các phần mềm chuyên dụng như ChemDraw, ChemSketch, MarvinSketch...Sau khi xây dựng được cấu trúc 3D, cấu tử cần chỉnh sửa điện tích, gắn trường lực và tối ưu hóa năng lượng để chuẩn bị cho docking.
Chuẩn bị protein
Cấu trúc 3D của protein thường có sẵn trên ngân hàng dữ liệu protein (Protein data bank) “http://www.rcsb.org”. Có thể tự xây dựng cấu trúc 3D của protein theo phương pháp mô hình hóa tương đồng (Homology modeling) nếu cấu trúc protein không có sẵn. Tiếp theo, chuẩn bị protein cho chương trình mô phỏng docking bằng các phần mềm chuyên dụng: loại nước và các cấu tử (nếu có), thêm hydro, gắn trường lực và tạo file pdbqt.
Mô phỏng docking
Trước khi tiến hành mô phỏng docking, cần khoanh vùng tìm kiếm (grid box) cho thuật toán. Kích thước của vùng tìm kiếm cần được cân đối, không nên quá lớn gây tốn kém thời gian và độ lặp lại không cao, cũng không nên quá nhỏ vì phần mềm chỉ tìm kiếm được một vùng rất nhỏ, không có ý nghĩa. Thông thường, vị trí vùng tìm kiếm được đặt ở trung tâm hoạt động của protein. Khi thực hiện docking, phần mềm sẽ tự động tìm kiếm và đưa ra cấu dạng phù hợp với năng lượng thấp nhất. Việc phân tích các tương tác của các cấu dạng thu được thực hiện trên các phần mềm chuyên dụng như MOE, Pymol, Discovery studio...
1.6.3. Quy tắc Lipinski về các hợp chất giống thuốc
Hầu hết các ứng cử viên làm thuốc thất bại trong các thử nghiệm lâm sàng bởi không đạt các chỉ tiêu về hiệu quả và độc tính. Năm 1997, Christopher Lipinski và các cộng sự đã đưa ra bộ quy tắc số 5 (Rules of 5- RO5) về các hợp chất giống thuốc, theo đó các loại thuốc dùng đường uống thường có đặc tính
hóa lý và cấu trúc trong một phạm vi giá trị nhất định. Một dược chất đường uống không vi phạm quá một trong 4 tiêu chí sau:
- Trọng lượng phân tử: MW < 500 Dalton.
- Số lượng nhóm cho liên kết hydro (Số lượng các nhóm –NH và –OH): HBD < 5.
- Số lượng nhóm nhận liên kết hydro (Bao gồm nguyên tử O và N): HBA < 10.
- Hệ số phân bố octanol/nước: LogP < 5 [52] .
Các thông số hóa lý này liên quan đến khả năng hòa tan trong nước, tính thấm ở ruột và bao gồm các bước đầu tiên trong sinh khả dụng đường uống. Nếu một hợp chất không vượt qua quy tắc RO5, nó sẽ có nguy cơ gặp vấn đề khi sử dụng đường uống. Tuy vậy một chất đáp ứng RO5 không đảm bảo nó sẽ trở thành thuốc, vì RO5 không đề cập đến các đặc điểm cấu trúc hóa học cụ thể được tìm thấy trong thuốc và hợp chất không phải thuốc.
CHƯƠNG 2. NGUYÊN LIỆU, THIẾT BỊ, NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Nguyên liệu và thiết bị
2.1.1. Cấu trúc protein
Cấu trúc tinh thể tia X của enzym HER2 với ID: 3PP0 được thu thập từ ngân hàng dữ liệu protein RCSB (www.rcsb.org) với độ phân giải 2,25Å [57]. Trong phức hợp 3PP0 đã chứa sẵn ligand đồng kết tinh 2-{2-[4-({5-chloro-6- [3-(trifluoromethyl)phenoxy]pyridin-3-yl}amino)-5Hpyrrolo[3,2-
d]pyrimidin-5 yl]ethoxy}ethanol mang ID 03Q trên ngân hàng dữ liệu RCSB.
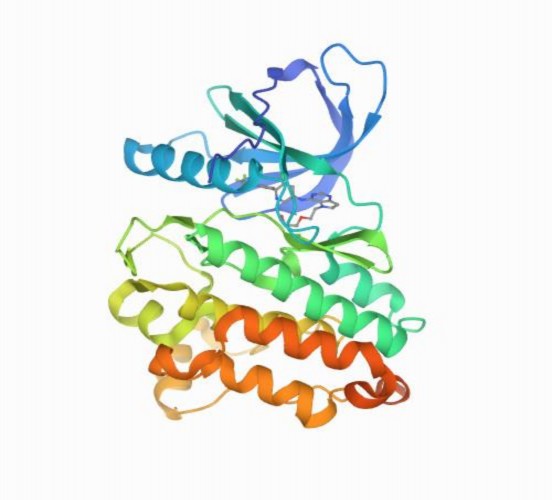
Hình 2.1 Cấu trúc 3D của enzym 3pp0 .
2.1.2. Cấu trúc phối tử