3
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
4.3639,940 0,561.21320
= 2,854.10-5
n n 2
4.136405400 213202
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 0,561.136405400 3639,940.21320
b =i1 i1 i1 i1=
= -0,0119
n n 2
4.136405400 213202
i
i
nC 2 C
i1
i1
Phương trình hồi quy thu được là: A = 2,854.10-5C - 0,0119 (C là nồng độ ppm Cu) thay A = 0,135
C = 4896,7 ppm = 4896,7 g/ml
Hàm lượng P : 4896,7 g/ml . 100,00ml = 489670 g 0,490g
Khối lượng Na2HPO4 tinh khiết là: 91%.
0,490 .142 = 2,243gam, độ tinh khiết
31
Bài 5:Chì được xác định bằng phương pháp hấp thụ nguyên tử ngọn lửa. Để giảm ảnh hưởng nhiễu, phương pháp thêm chuẩn được sử dụng. Tiến hành chuẩn bị ba mẫu, mỗi mẫu chứa 5,00 ml dung dịch mẫu cần xác định hàm lượng chì, trong mẫu thứ nhất thêm vào 5,00 ml nước cất. Mẫu thứ hai được thêm 1,00 ml dung dịch chì nitrat 10,0 M và 4,00 ml nước cất. Còn mẫu thứ ba được thêm 2,00 ml dung dịch chì nitrat 10,0 M và 4,00 ml nước cất. Ba mẫu đem đo phổ hấp thụ nguyên tử, độ hấp thụ thu được lần lượt là: 0,13; 0,30 và 0,47. Hãy xác định hàm lượng chì trong mẫu ban đầu?
Giải:
- Gọi nồng độ chì trong mẫu ban đầu là Co (M), trong mẫu thứ nhất là:
CX = 5, 00
5, 00 5, 00
Co = 0,5Co
- Nồng độ chì trong mẫu thứ 2 là CX + 1, 00.10, 0
5, 00 1, 00 4, 00
- Nồng độ chì trong mẫu thứ 3 là CX + 2, 00.10, 0
5, 00 2, 00 3, 00
= CX + 1,00 (M)
= CX + 2,00 (M)
Độ hấp thụ | 0,13 | 0,30 | 0,47 |
Nồng độ chì (M ) | 0 | 1,00 | 2,00 |
Có thể bạn quan tâm!
-
 Cấu Tạo Của Ngọn Lửa Đèn Khí.
Cấu Tạo Của Ngọn Lửa Đèn Khí. -
 Ảnh Hưởng Của Độ Nhớt Đến Tốc Độ Dẫn Mẫu (1Cp 1G/m.s)
Ảnh Hưởng Của Độ Nhớt Đến Tốc Độ Dẫn Mẫu (1Cp 1G/m.s) -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 6
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 6 -
 Đường Thêm Chuẩn Xác Định Hàm Lượng Đồng
Đường Thêm Chuẩn Xác Định Hàm Lượng Đồng -
![1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) 1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]
1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11] -
 Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh
Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh
Xem toàn bộ 167 trang tài liệu này.

Vì độ hấp thụ phụ thuộc tuyến tính vào nồng độ nên sử dụng phương pháp đồ thị theo bảng số liệu :
(Ngoại suy đồ thị, điểm cắt trục hoành là -Cx = 0,5Co;) hoặc xây dựng đường hồi qui tuyến tính A = aC + b và cho A = 0 thu được CX = - C.
Hàm lượng P (C) | Độ hấp thụ (A) | A.C | C2 | |
1 | 0 | 0,13 | 0,0000 | 0,00 |
2 | 1,00 | 0,30 | 0,3000 | 1,00 |
3 | 2,00 | 0,47 | 0,9400 | 4,00 |
n =3 | C = 3,00 | A = 0,90 | AC = 1,24 | C2 = 5,00 |
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
3.1,24 0,90.3,00
= 0,17
n n 2
3.5,00 3,002
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 0,90.5,001,24.3,00
b =i1 i1 i1 i1=
= 0,13
n n 2
3.5,00 3,002
i
i
nC 2 C
i1
i1
Phương trình hồi quy thu được là: A = 0,17C + 0,13
0,5
0,45
0,4
0,35
0,3
0,25
0,2
0,15
0,1
0,05
0
y = 0,17x + 0,13
R2 = 1
-2
-1
0
1
2
3
Hình 2.6: Đường thêm chuẩn xác định hàm lượng chì Kết quả thu được A = 0,17C + 0,13 - C = CX = 0,7647 = 0,5Co. Vậy nồng độ chì trong mẫu ban đầu là: Co = 1,5294 M.
Bài 6: Canxi trong dung dịch mẫu được xác định bằng phương pháp quang phổ hấp thụ nguyên tử. Dung dịch chuẩn được chuẩn bị bằng cách hoà tan 1,834 gam CaCl2.2H2O trong nước, pha loãng thành 1,00 lít, dung dịch này được pha loãng 1: 10. Các dung dịch chuẩn để đo được chuẩn bị bằng cách pha loãng dung dịch thứ hai theo tỉ lệ 1:20; 1:10 và 1:5. Mẫu được pha loãng theo tỉ lệ 1:25. Dung dịch SrCl2 được thêm vào các dung dịch trước khi pha loãng để đạt 1% (gam/100ml) để tránh ảnh hưởng photphat. Mẫu trắng được chuẩn bị là dung dịch SrCl2 1%. Tín hiệu độ hấp thụ được ghi khi các dung dịch được phun vào ngọn lửa không khí - axetylen cho kết quả sau :
Trắng | Mầu 1:20 | Mầu 1:10 | Mầu 1:5 | Mẫu phân tích | |
Độ hấp thụ | 1,5 | 10,6 | 20,1 | 38,5 | 29,6 |
Xác định nồng độ canxi trong mẫu dưới dạng ppm?
Giải:
- Nông độ Ca trong dung dịch chuẩn:
+ Dung dịch thu được khi pha 1,834 gam/L là:
1,834 .40
147
gam Ca/L
+ Dung dịch thu được khi pha tỉ lệ 1:10 là:
1,834 .4 = 0.050 gam Ca/L = 50 mg Ca/L.
147
hay nồng độ Canxi theo ppm là: 50 ppm.
- Gọi nồng độ Ca trong mẫu phân tích là Co (ppm).
Nồng độ Ca trong các dung dịch đo và tín hiệu độ hấp thụ tương ứng là:
Trắng | Mầu 1:20 | Mầu 1:10 | Mầu 1:5 | Mẫu phân tích | |
Nồng độ (ppm) | 0 | 2,5 | 5,0 | 10,0 | Co/25 |
Độ hấp thụ | 1,5 | 10,6 | 20,1 | 38,5 | 29,6 |
- Xây dựng sự phụ thuộc độ hấp thụ A vào nồng độ dựa trên nguyên lí bình phương tối thiểu A = aC + b:
Nồng độ (C) | Độ hấp thụ (A) | A.C | C2 | |
Trắng | 0 | 1,5 | 0 | 0 |
Mầu 1:20 | 2,5 | 10,6 | 26,5 | 6,25 |
Mầu 1:10 | 5,0 | 20,1 | 100,5 | 25,0 |
Mầu 1:5 | 10,0 | 38,5 | 385,0 | 100,0 |
n =4 | C = 17,5 | A = 70,7 | AC = 512,0 | C2 = 131,25 |
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
4.512,0 70,7.17,5
= 3,7063
n n 2
4.131,25 17,52
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 70,7.131,25 512,0.17,5
b =i1 i1 i1 i1=
= 1,46
n n 2
4.131,25 17,52
i
i
nC 2 C
i1
i1
- Phương trình hồi qui thu được: A = 3,7063.C + 1,46
- Hàm lượng Ca trong mẫu:
Co A 1, 46 29, 6 1, 46
25 3, 7063 3, 7063
Co = 189,8 ppm.
Bài 7:Clorua trong mẫu nước được xác định gián tiếp bằng phương pháp quang phổ hấp thụ nguyên tử bằng cách làm kết tủa hoàn toàn nó dưới dạng AgCl với lượng dư chính xác AgNO3, lọc bỏ kết tủa đo nồng độ còn lại của Ag trong dung dịch nước lọc. 10,00 ml của các dung dịch mẫu và dung dịch chuẩn 100 ppm clorua được cho vào bình eclen 100,0 ml khô, thêm vào mỗi bình 25,0 ml dung dịch AgNO3, sau một thời gian để kết tủa hoàn toàn, lắc chuyển các hỗn hợp sang các ống li tâm khô và đem li tâm. Mỗi dung dịch nước lọc (sau li tâm) được phun vào buồng nguyên tử hoá để xác định độ hấp thụ. Mẫu trắng được chuẩn bị tương tự khi dùng 10,0 ml nước cất. Kết quả thu được trên bảng sau:
Mẫu trắng | Mẫu chuẩn | Mẫu phân tích | |
Độ hấp thụ (chiều cao vạch hấp thụ (cm)) | 12,8 | 5,7 | 6,8 |
Nồng độ của clorua trong mẫu phân tích ban đầu là bao nhiêu ?
Giải:
- Gọi nồng độ của AgNO3 trong dung dịch chuẩn gốc là C01 mM.
- Phản ứng xảy ra trong quá trình chuẩn bị mẫu là :
Ag+ + Cl- AgCl
- Nồng độ Ag+ trong mẫu trắng : 25, 0 C01 = C1 (mM)
V
25, 0Co1 10 100
- Nồng độ Ag+ trong mẫu chuẩn :
35, 5
V
= C2 (mM)
- Nồng độ Ag+
trong mẫu phân tích :
25, 0Co1 10, 0Co V
X
= C3 (mM)
- Nồng độ và tín hiệu của các dung dịch đo:
Mẫu trắng | Mẫu chuẩn | Mẫu phân tích | |
Nồng độ | C1 | C2 | C3 |
12,8 | 5,7 | 6,8 |
Độ hấp thụ (chiều cao
- Ta có : A1 = KC1 = 12,8 (1) A2 = KC2 = 5,7 (2)
A3 = KC3 = 6,8 (3)
C1 12,8 25Co1
C01 = 2,0313 mM.
C2 5, 7 25Co1 10 100
35, 5
X
C1 12,8 =
25, 0Co1
C o = 2,3804 mM.
C3 6,8
25, 0Co1 10, 0Co X
Hàm lượng clorua trong mẫu là: 2,3804.35,5 = 84,5 ppm.
Bài 8: Bonert and Pohl báo cáo kết quả phân tích phổ hấp thụ nguyên tử đối với một số kim loại trong các sản phẩm phụ của quá trình sản xuất soda bằng phương pháp ammonia-soda.
a, Nồng độ của Cu được xác định bằng cách axit hoá 200 ml mẫu bằng 20,0 ml dung dịch HNO3, thêm vào 1,0 ml dung dịch H2O2 27% (khối lượng/thể tích) và đun sôi trong 30 phút. Dung dịch thu được được pha loãng thành 500 ml và đem phân tích hấp thụ nguyên tử. Kết quả phân tích cho trên bảng:
Nồng độ Cu (ppm) | Độ hấp thụ | |
trắng | 0 | 0.007 |
chuẩn 1 | 0.200 | 0.014 |
chuẩn 2 | 0.500 | 0.036 |
chuẩn 3 | 1.000 | 0.072 |
chuẩn 4 | 2.000 | 0.146 |
phân tích | 0.027 |
Hãy xác định nồng độ của Cu trong mẫu phân tích?
b, Nồng độ của Cr được xác định bằng cách axit hoá 200 ml mẫu bằng 20,0 ml dung dịch HNO3, thêm vào 0,20 gam Na2SO3 và đun sôi trong 30 phút. Lượng Cr được tách từ mẫu bằng cách thêm 20 ml NH3 tạo ra kết tủa chứa
Cr và một số oxit khác. Kết tủa được tách ra, rửa chuyển qua với nước rửa vào cốc. Sau khi được axit hoá bằng 10 ml dung dịch HNO3, được làm bay hơi đến khô. Cặn rắn được hoà tan lại bằng dung dịch HNO3 và HCl, làm bay hơi đến khô. Cuối cùng cặn rắn được hoà tan trong 5,00 ml dung dịch HCl và pha loãng thành 50,00 ml. Dung dịch thu được đem phân tích băng phương pháp thêm chuẩn. Kết quả hấp thụ nguyên tử được tổng hợp trên bảng sau:
Nồng độ Cr thêm (ppm) | Độ hấp thụ | |
trắng | 0 | 0.001 |
mẫu | 0 | 0.045 |
thêm chuẩn 1 | 0.200 | 0.083 |
thêm chuẩn 2 | 0.500 | 0.118 |
thêm chuẩn 3 | 1.000 | 0.192 |
Hãy xác định nồng độ của Cu trong mẫu phân tích?
Giải:
a) - Xây dựng sự phụ thuộc độ hấp thụ A vào nồng độ dựa trên nguyên lí bình phương tối thiểu A = aC + b:
Nồng độ (C) | Độ hấp thụ (A) | A.C | C2 | |
Trắng | 0 | 0,007 | 0 | 0 |
Chuẩn 1 | 0,200 | 0,014 | 0,003 | 0,040 |
Chuẩn 2 | 0,500 | 0,036 | 0,018 | 0,250 |
Chuẩn 3 | 1,000 | 0,072 | 0,072 | 1,000 |
Chuẩn 4 | 2,00 | 0,146 | 0,292 | 4,000 |
n =5 | C = 3,700 | A = 0,275 | AC = 0,385 | C2 = 5,290 |
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
5.0,385 0,275.3,700
= 0,071
n n 2
5.5,290 3,7002
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 0,275.5,290 0,385.3,700
b =i1 i1 i1 i1=
= 0,0024
n n 2
5.5,290 3,7002
i
i
nC 2 C
i1
i1
- Phương trình hồi qui thu được: A = 0,071C + 0,0024 C = 0,3465 ppm
- Hàm lượng Cu trong mẫu :
Co 500, 00.C 0,866ppm .
200, 00
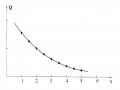
b) Xây dựng đồ thị thêm chuẩn với sự hiệu chỉnh mẫu trắng:
Vì độ hấp thụ phụ thuộc tuyến tính vào nồng độ nên sử dụng phương pháp đồ thị theo bảng số liệu:



![1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]](https://tailieuthamkhao.com/uploads/2022/08/29/xay-dung-he-thong-cau-hoi-va-bai-tap-mot-so-chuong-trong-phan-tich-li-hoa-9-1-120x90.jpg)
