DANH MỤC BẢNG
Trang
Bảng 1.1. Diện tích, sản lượng hồ tiêu của Việt Nam từ năm 2010-2019 6
Bảng 1.2. Diện tích, năng suất và sản lượng hồ tiêu một số vùng chính ở Việt Nam 7 Bảng 2.1 Sơ đồ bố trí thí nghiệm tuyển chọn các chủng vi khuẩn vùng rễ có tiềm năng kháng Phytophthora capsici 42
Bảng 2.2. Sơ đồ bố trí thí nghiệm tuyển chọn chủng vi sinh vật vùng rễ có khả năng kháng nấm Fusarium trên cây hồ tiêu con trong điều kiện vườn ươm 44
Bảng 2.3. Sơ đồ bố trí thí nghiệm tuyển chọn chủng vi sinh vật vùng rễ có khả năng kháng tuyến trùng Meloidogyne sp. trên cây hồ tiêu con trong điều kiện vườn ươm
...................................................................................................................................47
Bảng 2.4. Thành phần của môi trường nuôi cấy vi khuẩn 51
Bảng 2.5. Chương trình pha động trên cột C18 56
Bảng 3.1. Hiệu suất đối kháng nấm bệnh của các chủng vi khuẩn phân lập từ vùng rễ cây hồ tiêu tại 3 tỉnh Tây Nguyên 66
Có thể bạn quan tâm!
-
 Tuyển chọn, nghiên cứu đặc tính kháng tác nhân gây bệnh và tạo chế phẩm phòng trừ bệnh rễ của các chủng vi khuẩn vùng rễ cây hồ tiêu Piper nigrum L. tại Tây Nguyên - 1
Tuyển chọn, nghiên cứu đặc tính kháng tác nhân gây bệnh và tạo chế phẩm phòng trừ bệnh rễ của các chủng vi khuẩn vùng rễ cây hồ tiêu Piper nigrum L. tại Tây Nguyên - 1 -
 Thực Trạng Sản Xuất Hồ Tiêu Của Việt Nam Và Các Tỉnh Tây Nguyên
Thực Trạng Sản Xuất Hồ Tiêu Của Việt Nam Và Các Tỉnh Tây Nguyên -
 Bệnh Chết Chậm Trên Cây Hồ Tiêu Do Nấm Fusarium Sp. Và Tuyến Trùng
Bệnh Chết Chậm Trên Cây Hồ Tiêu Do Nấm Fusarium Sp. Và Tuyến Trùng -
 Các Giải Pháp Tổng Hợp Để Kiểm Soát Dịch Bệnh Trên Cây Hồ Tiêu Và Sản Xuất Bền Vững
Các Giải Pháp Tổng Hợp Để Kiểm Soát Dịch Bệnh Trên Cây Hồ Tiêu Và Sản Xuất Bền Vững
Xem toàn bộ 224 trang tài liệu này.
Bảng 3.2. Hiệu quả kháng Phytophthora capsici trên đoạn thân hồ tiêu 68
Bảng 3.3. Khả năng đối kháng của các chủng vi khuẩn vùng rễ đối với nấm Fusarium

trong điều kiện in vitro 69
Bảng 3.4. Khả năng kháng nấm Fusarium sp. trên đoạn thân hồ tiêu của 06 chủng vi khuẩn vùng rễ cây hồ tiêu 71
Bảng 3.5. Tỷ lệ tử vong tuyến trùng của 43 chủng vi khuẩn vùng rễ 73
Bảng 3.6. Ảnh hưởng của chủng vi khuẩn đến sinh trưởng thân, lá của cây hồ tiêu sau 90 ngày lây nhiễm Phytophthora capsici 75
Bảng 3.7. Ảnh hưởng của chủng vi khuẩn đến sinh trưởng rễ của cây hồ tiêu sau 90 ngày lây nhiễm Phytophthora 76
Bảng 3.8. Ảnh hưởng của chủng vi khuẩn vùng rễ đến một số chỉ tiêu sinh trưởng và kháng bệnh của cây hồ tiêu vườn ươm sau 90 ngày lây nhiễm Phytophthora 77
Bảng 3.9. Ảnh hưởng của các chủng vi khuẩn vùng rễ đến sinh trưởng thân và lá của cây hồ tiêu vườn ươm 80
Bảng 3.10. Ảnh hưởng của các chủng vi khuẩn vùng rễ đến sinh trưởng rễ và mật độ vi sinh vật tổng số trong đất của cây hồ tiêu vườn ươm 81
Bảng 3.11. Ảnh hưởng của chủng vi khuẩn đến một số chỉ tiêu sinh trưởng và kháng bệnh của cây hồ tiêu sau 120 ngày lây nhiễm nấm Fusarium 84
Bảng 3.12. Ảnh hưởng của các chủng vi khuẩn đến sinh trưởng thân và lá của cây hồ tiêu vườn ươm 85
Bảng 3.13. Ảnh hưởng của các chủng vi khuẩn đến rễ của cây hồ tiêu 87
Bảng 3.14. Ảnh hưởng của các chủng vi khuẩn đến một số chỉ tiêu bệnh trên cây hồ tiêu trong vườn ươm 88
Bảng 3.15. Đặc điểm hình thái và đặc tính sinh hóa của các chủng có hoạt tính kháng nấm và tuyến trùng cao 92
Bảng 3.16. Kết quả định danh bằng phương pháp giải trình tự gen 16S rRNA các chủng có hoạt tính kháng nấm và tuyến trùng cao 93
Bảng 3.17. Ảnh hưởng của môi trường nuôi cấy đến sinh trưởng của chủng RB.DS29
...................................................................................................................................98
Bảng 3.18. Ảnh hưởng của môi trường nuôi cấy đến sinh trưởng của chủng RB.CJ41 và RB.EK7 99
Bảng 3.19. Ảnh hưởng của pH đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7 100
Bảng 3.20. Ảnh hưởng của thời gian đến khả năng sinh trưởng của vi khuẩn RB.DS29
.................................................................................................................................101
Bảng 3.21. Ảnh hưởng của nhiệt độ đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7 103
Bảng 3.22. Ảnh hưởng của tốc độ lắc đến sinh trưởng của chủng RB.DS29, RB.CJ41 và RB.EK7 104
Bảng 3.23. Khả năng ức chế nấm bệnh của các dịch nuôi cấy chủng RB.DS29 106
Bảng 3.24. Các hợp chất thứ cấp kháng Phytophthora của của chủng RB.DS29 bằng phân tích GC-MS 108
Bảng 3.25. Phân tích LC- MS các hợp chất kháng Phytophthora của chủng RB.DS29
.................................................................................................................................109
Bảng 3.26. Khả năng ức chế nấm bệnh của các dịch nuôi cấy chủng RB.CJ41 110
Bảng 3.27. Kết quả phân tích GC-MS của chủng Bacillus subtilis RB.CJ41 chứa 8 chất có các đỉnh (peak) rõ 113
Bảng 3.28. Kết quả phân tích LC-MS của chủng Bacillus subtilis RB.CJ41 114
Bảng 3.29. Ảnh hưởng của dịch nuôi cấy chủng RB.EK7 đến tỷ lệ tử vong (%) tuyến trùng Meloidogyne sp. 115
Bảng 3.30. Ảnh hưởng của dịch nuôi cấy chủng RB.EK7 đến tỷ lệ nở của trứng tuyến trùng Meloidogyne sp. 117
Bảng 3.31 Kết quả phân tích GC-MS các hợp chất hoá học do chủng vi khuẩn RB.EK7 tổng hợp 119
Bảng 3.32 Khả năng ức chế tuyến trùng Meloidogyne sp. của cao chiết phân đoạn
.................................................................................................................................121
Bảng 3.33. Ảnh hưởng của dẫn xuất của Uracil đến tỷ lệ tử vong của tuyến trùng và tỷ lệ nở của trứng tuyến trùng 123
Bảng 3.34. Ảnh hưởng của dẫn xuất của Thymine đến tỷ lệ tử vong của tuyến trùng và tỷ lệ nở của trứng tuyến trùng 123
Bảng 3.35. Ảnh hưởng của hexahydropyrrolo [1,2-a] pyrazine-1,4-dione đến tỷ lệ tử vong của tuyến trùng và tỷ lệ nở của trứng tuyến trùng 124
Bảng 3.37. Hiệu suất đối kháng (%) nấm Fusarium sp. của dẫn xuất của Uracil, dẫn xuất của Thymine và hexahydropyrrolo [1,2-a] pyrazine-1,4-dione 125
Bảng 3.38. Ảnh hưởng của chất mang đến mật độ chủng RB.DS29 126
Bảng 3.39. Ảnh hưởng của chất mang đến khả năng kháng nấm của vi khuẩn Bacillus velezensis RB.DS29 128
Bảng 3.40. Ảnh hưởng của chất mang đến mật độ chủng RB.CJ41 129
Bảng 3.41. Ảnh hưởng của chất mang đến hiệu suất đối kháng (%) nấm Fusarium oxysporum của vi khuẩn Bacillus subtilis RB.CJ41 130
Bảng 3.43. Ảnh hưởng của chất mang đến hoạt tính kháng tuyến trùng trong in vitro
của chế phẩm chứa chủng RB.EK7 132
DANH MỤC HÌNH ẢNH
Trang
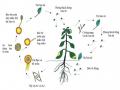
Hình 1.1. Vòng đời của Phytophthora capsici và tác nhân gây hại [37] 10
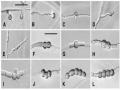
Hình 1.2. Bào tử hậu của các loài Fusarium [45], [50] 14
Hình 1.3. Bào tử đính lớn [53] 15
Hình 1.4. Sự hình thành và các loại bào tử đính nhỏ do các loài Fusarium tạo ra ...16 Hình 1.5. Chu kỳ sống của tuyến trùng sần rễ [64] 18
Hình 2.1. Thông số thiết bị MS/MS dùng để nhận danh 57
Hình 2.2 Quy trình điều chế cao chiết 59
Hình 2.3. Quy trình phân tách các hợp chất VK01, VK02, VK03 và VK05 60
Hình 2.4. Quy trình phân tách thu nhận hợp chất VK04 62
Hình 3.1 Khả năng kháng Phytophthora của một số chủng vi khuẩn sau 7 ngày 65
Hình 3.2. Tác động của vi khuẩn vùng rễ đến hệ sợi Phytophthora 67
Hình 3.3 Chiều dài của đoạn thân hồ tiêu sau 4 ngày lây nhiễm Phytophthora 68
Hình 3.4. Khả năng đối kháng nấm bệnh Fusarium của 6 chủng vi khuẩn vùng rễ.70 Hình 3.5. Khả năng kháng nấm Fusarium sp. của 06 chủng vi khuẩn vùng rễ trên đoạn thân hồ tiêu 71
Hình 3.6. Chiều cao cây hồ tiêu sau 90 ngày lây nhiễm với nấm bệnh 78
Hình 3.7. Chiều cao cây và chiều dài rễ của cây hồ tiêu vườn ươm 82
Hình 3.8 Mật độ vi sinh vật tổng số trong đất hồ tiêu ở các nghiệm thức 83
Hình 3.9. Ảnh hưởng của các chủng vi khuẩn đến mật độ VSV tổng số 91
Hình 3.10. Hình dạng khuẩn lạc và tế bào của 3 chủng RB.DS29, RB.CJ41 và RB.EK7 93
Hình 3.11. Kết quả so sánh mức độ tương đồng của chủng RB.DS29 với các chủng vi khuẩn trên cơ sở dữ liệu NCBI 94
Hình 3.12. Kết quả so sánh mức độ tương đồng của chủng RB.CJ41 với các chủng vi khuẩn trên cơ sở dữ liệu NCBI 94
Hình 3.13. Kết quả so sánh mức độ tương đồng của chủng RB.CJ41 với các chủng vi khuẩn trên cơ sở dữ liệu NCBI 95
Hình 3.14. Cây phân loại thể hệ mối liên quan giữa chủng RB.DS29, RB.CJ41 và RB.EK7 với các loài gần gũi dựa trên trình tự 16S rRNA 96
Hình 3.15. Mối tương quan giữa hoạt tính enzyme và hoạt tính kháng Phytophthora
.................................................................................................................................107
Hình 3.16. Mối tương quan giữa hoạt tính enzyme và hoạt tính kháng Fusarium.111 Hình 3.17. Hệ sợi nấm Fusarium dưới tác động của dịch nuôi cấy vi khuẩn RB.CJ41khi bổ sung bào tử nấm Fusarium sp. 112
Hình 3.18. Mối tương quan giữa hoạt tính enzyme và tỷ lệ tử vong tuyến trùng...116 Hình 3.19. Tác động của enzyme ngoại bào của vi khuẩn vùng rễ đến quá trình nở của trứng tuyến trùng và gây chết tuyến trùng trưởng thành 118
Hình 3.20. Sắc ký lớp mỏng các hợp chất phân tách 122
MỞ ĐẦU
1. Tính cấp thiết của luận án
Hồ tiêu (Piper nigrum L.) là cây công nghiệp có giá trị kinh tế và xuất khẩu cao của Việt Nam. Sản lượng hạt tiêu của Việt Nam chiếm tới 40% tổng sản lượng hạt tiêu toàn cầu. Theo quy hoạch đến năm 2020, tầm nhìn đến 2025, diện tích hồ tiêu của cả nước là 50.000 ha, nhưng chỉ trong vài năm gần đây, riêng Tây Nguyên đã có tới gần 93.000 ha, nâng tổng diện tích hồ tiêu cả nước lên 150.000 ha. Năm 2020, xuất khẩu hạt tiêu ước đạt 288 nghìn tấn, trị giá 665 triệu USD, tăng 1,2% về lượng, nhưng giảm 6,8% về trị giá so với cùng kỳ năm 2019 [1]. Trong những năm gần đây, trước tình trạng diện tích hồ tiêu phát triển quá nhanh, nhiều vườn hồ tiêu được đầu tư thâm canh cao độ, dịch bệnh được xem là yếu tố quan trọng hàng đầu dẫn đến việc nhiều vườn tiêu bị phá hủy. Hiện tượng hồ tiêu chết hàng loạt ở nhiều vùng trên cả nước đặc biệt là Tây Nguyên đã ảnh hưởng rất lớn đến sự phát triển bền vững của ngành hồ tiêu Việt Nam. Theo số liệu thống kê, diện tích hồ tiêu đạt cao điểm vào năm 2017 là 151.982 ha, sau đó giảm dần qua từng năm 2018 và 2019 còn 140.000 ha, giảm 11.900 ha qua hai năm do dịch bệnh. Nguyên nhân diện tích giảm do dịch bệnh chủ yếu là bệnh chết nhanh và bệnh vàng lá chết chậm. Bệnh chết nhanh do Phytophthora capsici và bệnh vàng lá chết chậm do tuyến trùng ký sinh thực vật Meloidogyne kết hợp với nấm Fusarium sp. được xem là bệnh rễ phổ biến và nghiêm trọng nhất trên cây hồ tiêu hiện nay [2-8].
Ba biện pháp được sử dụng nhiều nhất trong quản lý bệnh chết nhanh và chết chậm trên cây hồ tiêu gồm sử dụng các giống kháng, luân canh cây trồng và dùng các thuốc hóa học để diệt nấm [9-11]. Tuy nhiên, việc sử dụng các thuốc hoá học diệt nấm sẽ gây ô nhiễm môi trường, giảm chất lượng sản phẩm, đa dạng vi sinh vật và tăng sự đề kháng của tác nhân lây bệnh [12]. Gần đây, các nghiên cứu sử dụng các tác nhân kiểm soát sinh học thân thiện với môi trường đang được ưu tiên hàng đầu trong các chương trình quản lý dịch hại tổng hợp nhằm thay thế cho hóa chất nông nghiệp. Các tác nhân kiểm soát sinh học như nấm đối kháng, vi khuẩn nội sinh, vùng rễ kháng nấm bệnh, tuyến trùng và kích thích sinh trưởng bộ rễ [13-14]. Trong đó, vi khuẩn vùng rễ (Rhizobacteria) kháng nấm bệnh, tuyến trùng và thúc đẩy sinh trưởng thực vật đang được nhiều nghiên cứu quan tâm [15-17]. Vi khuẩn vùng rễ cạnh tranh với vi sinh vật gây
bệnh tại vùng rễ để làm giảm nguồn bệnh phát sinh từ đất và thúc đẩy sinh trưởng ở thực vật một cách trực tiếp dựa trên hoạt tính cố định N, phân giải P khó tan và sinh tổng hợp IAA. Sử dụng vi khuẩn vùng rễ làm chế phẩm vi sinh được coi là xu hướng trong tương lai vì nó làm giảm đáng kể việc sử dụng hóa chất, phân bón hoá học từ đó góp phần làm tăng năng suất, chất lượng sản phẩm một cách bền vững [16-26]. Hướng nghiên cứu về ảnh hưởng của các chủng vi khuẩn vùng rễ đến khả năng sinh trưởng và kháng bệnh rễ trên cây hồ tiêu còn được ít quan tâm ở Việt Nam và chưa có nghiên cứu nào một cách hệ thống trên cây hồ tiêu ở khu vực Tây Nguyên. Vì vậy, đề tài nghiên cứu “Tuyển chọn, nghiên cứu đặc tính kháng tác nhân gây bệnh và tạo chế phẩm phòng trừ bệnh rễ của các chủng vi khuẩn vùng rễ cây hồ tiêu ( Piper nigrum L.) tại Tây Nguyên” là rất cần thiết.
2. Mục tiêu nghiên cứu của luận án
Tuyển chọn, xác định được đặc tính kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne và tạo chế phẩm phòng trừ bệnh rễ của các chủng vi khuẩn vùng rễ cây hồ tiêu (Piper nigrum L.) tại Tây Nguyên.
3. Các nội dung nghiên cứu chính của luận án
1. Tuyển chọn các chủng vi khuẩn phân lập từ vùng rễ cây hồ tiêu tại Tây Nguyên, định danh các chủng có tiềm năng kháng Phytophthora, Fusarium và kháng tuyến trùng Meloidogyne gây bệnh rễ trên cây hồ tiêu tại Tây Nguyên.
2. Nghiên cứu đặc tính và xác định hoạt chất kháng Phytophthora, Fusarium, tuyến trùng Meloidogyne của các chủng vi khuẩn tiềm năng được tuyển chọn.
3. Bước đầu tạo chế phẩm vi sinh phòng trừ nấm và tuyến trùng từ các chủng vi khuẩn tuyển chọn.
4.Ý nghĩa khoa học và ý nghĩa thực tiễn
4.1. Ý nghĩa khoa học
Xác định một số chủng vi khuẩn vùng rễ có khả năng kháng Phytophthora sp., Fusarium sp. và tuyến trùng Meloidogyne sp. gây bệnh rễ trên cây hồ tiêu đồng thời cung cấp dẫn liệu khoa học về khả năng đối kháng của một số chủng vi khuẩn làm cơ sở khoa học cho việc nghiên cứu và ứng dụng các vi khuẩn đối kháng làm chế phấm sinh học phòng trừ Phytophthora sp., Fusarium sp. và tuyến trùng Meloidogyne sp.
4.2. Ý nghĩa thực tiễn
Góp phần vào việc tạo ra các chế phẩm sinh học để phòng trừ bệnh rễ do Phytophthora sp., Fusarium sp. và tuyến trùng Meloidogyne sp. gây nên nhằm ứng dụng các biện pháp sinh học phòng trừ bệnh rễ trên cây hồ tiêu có hiệu quả tốt và an toàn với môi trường tự nhiên và sức khỏe con người.
5. Phạm vi nghiên cứu
Vùng chuyên canh hồ tiêu của ba tỉnh Tây Nguyên là Đắk Lắk, Đắk Nông và Gia Lai.
Nghiên cứu phân lập, sàng lọc hoạt tính sinh học các chủng vi khuẩn vùng rễ có khả năng kháng bệnh rễ trên cây hồ tiêu được thực hiện trong phòng thí nghiệm, các thực nghiệm nhà lưới.